Enzim adalah molekul protein (biasanya ditunjukan dengan akhiran “ase”) berlaku sebagai katalisator untuk perubahan tingkat reaksi yang terjadi di dalam tubuh. Enzim di golongkan menurut jenis reaksi pengkatalisasinya.

Enzim adalah molekul protein (biasanya ditunjukan dengan akhiran “ase”) berlaku sebagai katalisator untuk perubahan tingkat reaksi yang terjadi di dalam tubuh. Enzim di golongkan menurut jenis reaksi pengkatalisasinya.
Enzim adalah biomolekul berupa protein berbentuk bulat (globular), yang terdiri atas satu rantai polipeptida atau lebih dari satu rantai polipeptida (Wirahadikusumah, 1989). Enzim berfungsi sebagai katalis atau senyawa yang dapat mempercepat proses reaksi tanpa habis bereaksi. Dengan adanya enzim, molekul awal yang disebut substrat akan dipercepat perubahannya menjadi
molekul lain yang disebut produk (Smith, 1997; Grisham et al., 1999).
Keunggulan enzim sebagai biokatalisator antara lain memiliki spesifitas tinggi, mempercepat reaksi kimia tanpa pembentukkan produk samping, produktivitas tinggi dan dapat menghasilkan produk akhir yang tidak terkontaminasi sehingga mengurangi biaya purifikasi dan efek kerusakan lingkungan (Chaplin and Bucke, 1990).
Klasifikasi enzim dapat dibedakan sebagai berikut :
Berdasarkan tempat bekerjanya, enzim dibedakan menjadi dua, yaitu:
Endoenzim, disebut juga enzim intraseluler, yaitu enzim yang bekerja di dalam sel.
Eksoenzim, disebut juga enzim ekstraseluler, yaitu enzim yang bekerja di luar sel.
Berdasarkan cara terbentuknya, enzim dibedakan menjadi dua, yaitu:
Enzim konstitutif, yaitu enzim yang jumlahnya dipengaruhi kadar substratnya, misalnya enzim amilase.
Enzim adaptif, yaitu enzim yang pembentukannya dirangsang oleh adanya substrat, contohnya enzim β-galaktosidase yang dihasilkan oleh bakteri E.coli yang ditumbuhkan di dalam medium yang mengandung laktosa (Lehninger, 1982).
Sifat-sifat katalitik dari enzim ialah sebagai berikut:
Enzim mampu meningkatkan laju reaksi pada kondisi biasa (fisiologik) dari tekanan, suhu dan pH.
Enzim mempunyai selektifitas tinggi terhadap substrat (substansi yang mengalami perubahan kimia setelah bercampur dengan enzim) dan jenis reaksi yang dikatalisis.
Enzim memberikan peningkatan laju reaksi yang tinggi dibanding dengan katalis biasa (Page, 1989).
Beberapa faktor yang mempengaruhi aktivitas enzim adalah sebagai berikut:
Suhu
Enzim dapat mempercepat terjadinya reaksi kimia pada suatu sel hidup. Dalam batas-batas suhu tertentu, kecepatan reaksi yang dikatalisis enzim akan meningkat seiring dengan naiknya suhu. Reaksi yang paling cepat terjadi pada suhu optimum (Rodwell, 1987). Suhu yang terlalu tinggi akan menyebabkan enzim terdenaturasi (Poedjiadi, 1994). Pada suhu 0oC, enzim menjadi tidak aktif dan dapat kembali aktif pada suhu normal (Lay dan Sugyo, 1992). Hubungan antara aktivitas enzim dengan suhu ditunjukkan dalam Gambar dibawah ini.
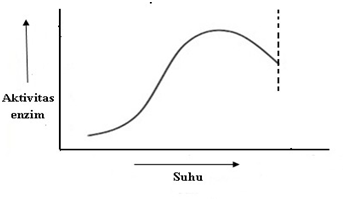
Gambar. Hubungan aktivitas enzim dengan suhu (Rodwell, 1987).
pH
Enzim pada umumnya bersifat amfolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya, terutama gugus terminal karboksil dan gugus terminal amino. Perubahan kereaktifan enzim diperkirakan merupakan akibat dari perubahan pH lingkungan (Winarno, 1989). Hubungan kecepatan reaksi dengan pH ditunjukkan pada Gambar dibawah ini.
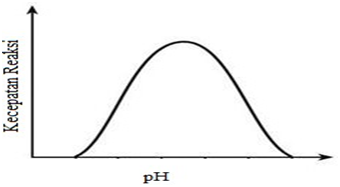
Gambar. Hubungan kecepatan reaksi dengan pH (Winarno, 1989).
Konsentrasi enzim
Semakin tinggi konsentrasi enzim maka kecepatan reaksi akan meningkat hingga batas konsentrasi tertentu. Namun, hasil hidrolisis substrat akan konstan dengan naiknya konsentrasi enzim. Hal ini disebabkan penambahan enzim sudah tidak efektif lagi (Reed, 1975). Hubungan antara laju reaksi enzim dengan konsentrasi enzim ditunjukkan dalam Gambar dibawah ini.

Gambar Hubungan laju reaksi dengan konsentrasi enzim (Reed, 1975).
Konsentrasi substrat
Kecepatan reaksi enzimatis pada umumnya tergantung pada konsentrasi substrat. Kecepatan reaksi akan meningkat apabila konsentrasi substrat meningkat. Peningkatan kecepatan reaksi ini akan semakin kecil hingga tercapai suatu titik batas yang pada akhirnya penambahan konsentrasi subtrat hanya akan sedikit meningkatkan kecepatan reaksi (Lehninger, 1982).
Aktivator dan inhibitor
Beberapa enzim memerlukan aktivator dalam reaksi katalisnya. Aktivator adalah senyawa atau ion yang dapat meningkatkan kecepatan reaksi enzimatis. Komponen kimia yang membentuk enzim disebut juga kofaktor. Kofaktor tersebut dapat berupa ion-ion anorganik seperti Zn, Fe, Ca, Mn, Cu, Mg atau dapat pula sebagai molekul organik kompleks yang disebut koenzim (Martoharsono, 1997).
Menurut Wirahadikusumah (1989), inhibitor merupakan suatu zat kimia tertentu yang dapat menghambat aktivitas enzim. Pada umumnya cara kerja inhibitor adalah dengan menyerang sisi aktif enzim sehingga enzim tidak dapat berikatan dengan substrat sehingga fungsi katalitiknya terganggu (Winarno, 1989).
Enzim merupakan katalisator protein yang mempercepat reaksi kimia dalam makhluk hidup atau dalam sistem biologik (Suhartono, 1992). Suatu enzim dapat mempercepat laju reaksi kira-kira 108 sampai 1011 kali lebih cepat dibandingkan dengan reaksi yang tidak dikatalisisis (Poedjiadi, 1994). Molekul enzim biasanya berbentuk bulat (globular), sebagian terdiri atas satu rantai polipeptida dan sebagian lain terdiri dari lebih dari satu polipeptida (Wirahadikusumah, 1997) dan umumnya mempunyai berat molekul yang beraneka ragam berkisar 104–107 kDa (Dryer, 1993).
Enzim bekerja sangat spesifik dalam kerja katalitiknya, sehingga enzim dikatakan mempunyai sifat sangat khas karena hanya bekerja pada substrat tertentu dan bentuk reaksi tertentu. Kespesifikan ini disebabkan oleh bentuknya yang unik dan adanya gugus-gugus polar atau nonpolar dalam struktur enzim (Fesssenden, 1992). Salah satu fungsi yang paling menonjol dari protein adalah aktivitas enzim. Enzim mempunyai fungsi khusus antara lain yaitu :
Kelebihan enzim dibandingkan katalis biasa adalah enzim bersifat spesifik dibandingkan dengan katalis anorganik, bekerja pada pH yang relatif netral dan suhu yang relatif rendah, aman, mudah dikontrol, dapat menggantikan bahan kimia yang berbahaya, serta dapat didegradasi secara biologis (Page, 1997).
Enzim telah banyak digunakan dalam bidang industri pangan, farmasi dan industri kimia lainnya. Dalam bidang pangan misalnya amilase, glukosa-isomerase, papain dan bromelin. Sedangkan dalam bidang kesehatan contohnya amilase, lipase dan protease. Dalam banyak aplikasi bioteknologi, selulase digunakan dalam proses sakarifikasi bahan berselulosa, deterjen, industri makanan, dan pengolahan limbah pabrik kertas (Busto et al., 1995; Akiba et al., 1995). Enzim dapat diisolasi dari hewan, tumbuhan dan mikroorganisme. Namun, secara umum enzim diisolasi dari mikroorganisme karena pertumbuhan mikroorganisme relatif lebih cepat sehingga enzim yang dihasilkan lebih banyak.
Klasifikasi enzim dapat dibedakan sebagai berikut :
Berdasarkan tempat bekerjanya enzim dibedakan menjadi dua, yaitu :
Berdasarkan fungsinya enzim dapat dibedakan menjadi enam kelas dan tiap kelas mempunyai beberapa subkelas. Dalam tiap subkelas, nama resmi dan nomor klasifikasi dari tiap enzim melukiskan reaksi yang dikatalisis berdasarkan IUPAC yaitu :
Berdasarkan cara terbentuknya dibedakan menjadi dua, yaitu :
Sifat-sifat katalitik dari enzim sebagai berikut :
Beberapa faktor yang mempengaruhi aktivitas enzim sebagai berikut :
Suhu
Enzim mempercepat terjadinya reaksi kimia pada suatu sel hidup. Dalam batas-batas suhu tertentu, kecepatan reaksi yang dikatalisis enzim akan naik bila suhunya naik. Reaksi yang paling cepat terjadi pada suhu optimum (Rodwell, 1988). Suhu yang terlalu tinggi akan menyebabkan enzim terdenaturasi (Poedjiadi, 1994). Pada suhu 0oC enzim tidak aktif (tidak rusak) dan dapat kembali aktif pada suhu normal (Lay and Sugyo, 1992).
pH
Enzim pada umumnya bersifat amfolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya, terutama pada gugus residu terminal karboksil dan gugus terminal aminonya, diperkirakan perubahan kereaktifan enzim akibat perubahan pH lingkungan (Winarno, 1986).
Konsentrasi enzim
Konsentrasi enzim secara langsung mempengaruhi kecepatan laju reaksi enzimatik dimana laju reaksi meningkat dengan bertambahnya konsentrasi enzim (Poedjiadi, 1994). Laju reaksi tersebut meningkat secara linier selama konsentrasi enzim jauh lebih sedikit daripada konsentrasi substrat. Hal ini biasanya terjadi pada kondisi fisiologis (Page, 1997).
Konsentrasi substrat
Kecepatan reaksi enzimatis pada umumnya tergantung pada konsentrasi substrat. Kecepatan reaksi akan meningkat apabila konsentrasi substrat meningkat. Peningkatan kecepatan reaksi ini akan semakin kecil hingga tercapai suatu titik batas yang pada akhirnya penambahan konsentrasi subtrat hanya akan sedikit meningkatkan kecepatan reaksi (Lehninger, 1982).
Aktivator dan inhibitor
Beberapa enzim memerlukan aktivator dalam reaksi katalisnya. Aktivator adalah senyawa atau ion yang dapat meningkatkan kecepatan reaksi enzimatis. Komponen kimia yang membentuk enzim disebut juga kofaktor. Kofaktor tersebut dapat berupa ion-ion anorganik seperti Zn, Fe, Ca, Mn, Cu atau Mg atau dapat pula sebagai molekul organik kompleks yang disebut koenzim (Martoharsono, 1984).
Menurut Wirahadikusumah (1997) inhibitor merupakan suatu zat kimia tertentu yang dapat menghambat aktivitas enzim. Pada umumnya cara kerja inhibitor adalah dengan menyerang sisi aktif enzim sehingga enzim tidak dapat berikatan dengan substrat dan fungsi katalitik enzim tersebut akan terganggu (Winarno, 1986).
Teori pembentukan enzim-substrat
Cara kerja enzim dapat dijelaskan dengan dua teori, yaitu teori kunci-gembok (lock and key theory) dan teori kecocokan yang terinduksi (induced fit theory), ditunjukkan dalam Gambar dibawah ini.
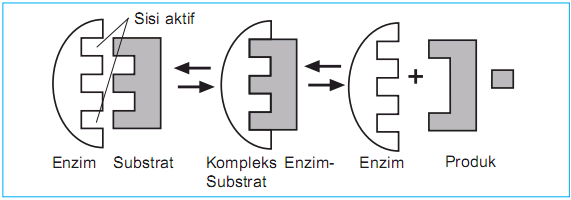
Menurut teori kunci-gembok, enzim dan substrat bergabung bersama membentuk kompleks, seperti kunci yang masuk dalam gembok. Hal ini dikarenakan adanya kesesuaian bentuk ruang antara substrat dengan sisi aktif enzim, sehingga sisi aktif enzim cenderung kaku. Di dalam kompleks, substrat dapat bereaksi dengan energi aktivasi yang rendah. Setelah bereaksi, kompleks lepas dan melepaskan produk serta membebaskan enzim.
Sedangkan menurut teori kecocokan yang terinduksi, sisi aktif enzim merupakan bentuk yang fleksibel. Ketika substrat memasuki sisi aktif enzim, bentuk sisi aktif termodifikasi melingkupi substrat membentuk kompleks. Ketika produk dihasilkan, maka enzim akan dilepaskan dalam bentuk bebas dan dapat bereaksi kembali dengan substrat yang baru.
Enzim merupakan katalisator pilihan yang diharapkan dapat mengurangi dampak pencemaran lingkungan dan pemborosan energi karena reaksinya tidak membutuhkan energi, bersifat spesifik dan tidak beracun. Enzim telah dimanfaatkan secara luas pada berbagai industri produk pertanian, kimia dan industri obat-obatan. Tiga sifat utama dari biokatalisator adalah menaikkan kecepatan reaksi, mempunyai kekhususan dalam reaksi dan produk serta kontrol kinetik (Akhdiya, 2003).
Enzim memegang peranan penting dalam proses pencernaan makanan maupun proses metabolisme zat-zat makanan dalam tubuh. Fungsi enzim adalah mengurangi energi aktivasi, yaitu energi yang diperlukan untuk mencapai status transisi (suatu bentuk dengan tingkat energi tertinggi) dalam suatu reaksi kimiawi. Suatu reaksi yang di katalisis oleh enzim mempunyai energi aktivasi yang lebih rendah, dengan demikian membutuhkan lebih sedikit energi untuk berlangsungnya reaksi tersebut. Enzim mempercepat reaksi kimiawi secara spesifik tanpa pembentukan hasil samping dan bekerja pada larutan dengan keadaan suhu dan pH tertentu. Aktivitas enzim dapat dipengaruhi oleh beberapa faktor, seperti konsentrasi enzim, konsentrasi substrat, suhu dan pH (Pelczar dan Chan, 2005).
Enzim dapat diperoleh dari sel-sel hidup dan dapat bekerja baik untuk reaksi-reaksi yang terjadi di dalam sel maupun di luar sel. Pemanfaatan enzim untuk reaksi-reaksi yang terjadi di luar sel banyak diaplikasikan dalam dunia industri seperti industri makanan, deterjen, penyamakan kulit, kosmetik, dll (Moon dan Parulekar, 1993). Pemanfaatan enzim dapat dilakukan secara langsung menggunakan enzim hasil isolasi maupun dengan cara pemanfaatan mikroorganisme yang dapat menghasilkan enzim yang diinginkan.
Enzim dapat diperoleh dari makhluk hidup seperti hewan, tumbuhan dan mikroorganisme. Beberapa contoh enzim protease yang bersumber dari tumbuhan yaitu bromelin dari nanas, papain dari pepaya, lisozim dari putih telur. Meskipun banyak sumber dapat menghasilkan enzim yang berasal dari hewan dan tumbuhan, namun pemanfaatan mikroorganisme sebagai sumber enzim lebih banyak diminati, karena enzim dari mikroorganisme dapat dihasilkan dalam waktu yang sangat singkat, mudah diproduksi dalam skala besar, proses produksi bisa dikontrol, kemungkinan terkontaminasi oleh senyawa-senyawa lain lebih kecil, dan dapat diproduksi secara berkesinambungan dengan biaya yang relatif rendah (Thomas, 1989).
Enzim sebagai suatu senyawa yang berstruktur protein baik murni maupun protein yang terikat pada gugus non protein, memiliki sifat yang sama dengan protein lain yaitu :
Enzim yang diisolasi dari sumber alamnya dapat dipakai secara in vitro untuk penelitian secara rinci reaksi-reaksi yang dikatalisis. Laju reaksi dapat diubah dengan mengubah parameter-parameternya seperti pH, suhu dan dengan mengubah secara kualitatif maupun kuantitatif komposisi ion dari medianya atau dengan mengubah ligand selain substrat atau koenzim (Poedjiadi, 1994).
Molekul-molekul enzim merupakan katalis yang sangat efisien dalam mempercepat pengubahan substrat menjadi produk-produk akhir. Satu molekul enzim tunggal dapat melakukan perubahan sebanyak seribu molekul substrat per detik. Kenyataan ini sekaligus menjelaskan bahwa molekul enzim tidak dikonsumsi ataupun mengalami perubahan selama proses reaksi berlangsung. Namun demikian ada beberapa hal yang perlu diperhatikan bahwa enzim tidak stabil aktivitasnya dan dapat berkurang atau bahkan menghilang oleh berbagai pengaruh baik kondisi fisik maupun kimia seperti suhu, pH, dan lain sebagainya (Pelczar dan Chan, 2005).
Laju katalisis enzim dapat dipengaruhi dengan mencolok bahkan hanya dengan perubahan-perubahan kecil dalam lingkungan kimianya dan di dalam batasan fisiologisnya, dan perubahan-perubahan ini jelas berperan dalam pengontrolan dan pengaturan sistem enzim yang saling berhubungan yang diperlukan untuk sel-sel kehidupan (Poedjiadi, 1994).
Enzim sebagai biokatalisator berstruktur protein, dalam mekanisme kerja aktivitasnya dipengaruhi oleh beberapa faktor antara lain, pH, suhu, konsentrasi substrat, konsentrasi enzim, kehadiran aktivator atau inhibitor (Poedjiadi, 1994).
Potensial Hidrogen (pH) merupakan salah satu faktor penting yang harus diperhatikan apabila bekerja dengan enzim, hal ini dikarenakan enzim hanya mampu bekerja pada kondisi pH tertentu saja. Suatu kondisi pH dimana enzim dapat bekerja dengan aktivitas tertinggi yang dapat dilakukannya dinamakan pH optimum. Sebaliknya pada pH tertentu enzim sama sekali tidak aktif atau bahkan rusak. Hal ini dapat dijelaskan karena diketahui bahwa enzim merupakan molekul protein, molekul protein kestabilannya dapat dipengaruhi oleh tingkat keasaman lingkungan, pada kondisi keasaman yang ekstrim molekul-molekul protein dari enzim akan rusak.
Seperti halnya pH, aktivitas kerja enzim juga dipengaruhi oleh temperatur lingkungan dimana enzim bekerja. Sama seperti reaksi kimia biasa, suhu biasanya dapat mempercepat proses reaksi, namun demikian pada titik suhu tertentu kecepatan reaksi yang dikatalisis oleh enzim akan mulai menurun bahkan aktivitasnya tidak lagi nampak. Kondisi suhu dimana enzim dapat menghasilkan aktivitas tertinggi dinamakan suhu atau temperatur optimum. Oleh karena enzim berstruktur protein, sebagaimana diketahui bahwa protein dapat dirusak oleh panas, sehingga pada suhu tinggi tertentu aktivitas enzim mulai menurun dan bahkan aktivitasnya menghilang. Hal ini sangat dimungkinkan karena terjadinya denaturasi atau kerusakan struktur enzim yang dapat menyebabkan kerusakan enzim baik secara keseluruhan maupun sebagian terutama sisi aktifnya.
Reaksi-reaksi biokimia yang dikatalisis oleh enzim dipengaruhi pula oleh jumlah substrat. Jika melakukan pengujian konsentrasi substrat dari rendah ke tinggi terhadap kecepatan reaksi enzimatis, maka pada awalnya akan diperoleh hubungan kesebandingan yang menyatakan kecepatan reaksi akan meningkat seiring dengan meningkatnya konsentrasi substrat, namun kemudian akan diperoleh data yang menyatakan pada konsentrasi substrat tinggi tertentu kecepatan reaksi tidak lagi bertambah. Pada kondisi ini konsentrasi substrat menjadi jenuh dan kecepatan reaksi menjadi maksimum yang sering juga disebut sebagai kecepatan maksimum (Vmax).
Seperti pada katalis lain, kecepatan suatu reaksi yang menggunakan enzim tergantung pada konsentrasi enzim tersebut. Pada suatu konsentrasi substrat tertentu, kecepatan reaksi bertambah dengan bertambahnya konsentrasi enzim. Sejumlah besar enzim membutuhkan suatu komponen lain untuk dapat berfungsi sebagai katalis. Komponen ini secara umum disebut kofaktor. Kofaktor ini dapat dibagi dalam tiga kelompok, yaitu : gugus prostetik, koenzim dan aktivator. Aktivator pada umumnya ialah ion-ion logam yang dapat terikat atau mudah terlepas dari enzim. Contoh aktivator logam adalah K+, Mn++, Mg++, Cu++, atau Zn++ (Poedjiadi, 1994).
Mekanisme enzim dalam suatu reaksi ialah melalui pembentukan kompleks enzim-substrat (ES). Oleh karena itu hambatan atau inhibisi pada suatu reaksi yang menggunakan enzim sebagai katalis dapat terjadi apabila penggabungan substrat pada bagian aktif enzim mengalami hambatan. Molekul atau ion yang dapat menghambat reaksi tersebut dinamakan inhibitor (Poedjiadi, 1994).
Enzim berfungsi sebagai katalis, suatu enzim dapat mempercepat reaksi 108 sampai 1011 kali lebih cepat daripada reaksi tanpa katalis. Jadi enzim dapat berfungsi sebagai katalis yang sangat efisien, disamping itu juga mempunyai derajat kekhasan yang tinggi. Enzim dapat menurunkan energi aktivasi sehingga reaksi lebih mudah terjadi, sedangkan tanpa menggunakan katalis reaksi akan lebih sulit terjadi. Katalis akan menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Dengan adanya katalis akan mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi (Richana, et al, 2008).
Suatu enzim mempunyai kekhasan, yaitu hanya bekerja pada satu reaksi saja, beberapa enzim memiliki spesifisitas yang hampir absolut bagi substrat tertentu, dan tidak akan bekerja bahkan terhadap molekul yang amat serupa. Kebanyakan reaksi enzim dapat dinyatakan dengan persamaan reaksi keseluruhan sebagai berikut :

Enzim (E) dan substrat (S) bergabung menjadi kompleks enzim-substrat ES, yang kemudian terurai menjadi produk P. Enzim tidak terkonsumsi dalam reaksi tersebut tetapi dilepaskan kembali untuk reaksi selanjutnya dengan molekul substrat yang lain. Proses ini berulang-ulang sampai semua molekul substansi yang tersedia habis terpakai. Pokok dalam teori mekanisme kerja enzim adalah konsep aktivasi substrat yang terjadi setelah pembentukan kompleks enzim-substrat (ES). Aktivasi memungkinkan substrat diubah oleh kerja enzim. Terjadinya aktivasi molekul substrat ini disebabkan oleh aktivasi kimiawi substrat yang tinggi terhadap daerah-daerah tertentu pada permukaan enzim yang disebut situs aktif. Ketegangan atau distorsi yang dihasilkan pada beberapa ikatan pada molekul substrat membuatnya labil (tidak mantap), dan mengalami perubahan itu tidak lagi mempunyai aktivitas terhadap situs aktif tadi dan karenanya dilepaskan. Enzimnya kemudian bebas untuk bergabung lagi dengan substrat berikutnya dan demikianlah proses tersebut berulang (Richana, et al, 2008).
Enzim digolongkan menurut reaksi yang diikutinya, sedangkan masingmasing enzim diberi nama menurut nama substratnya, misalnya urase, arginase Enzim (E) + substrat (S) kompleks enzim substrat (ES) produk § + Enzim (E) tetapi ada pula beberapa enzim dikenal dengan nama lama misalnya pepsin, tripsin dan lain-lain. Commision on Enzimes of the International Union of Biochemistry, menggolongkan enzim berdasarkan atas reaksi kimia dimana enzim
memegang peranan yaitu :
Oksida Reduktase
Enzim-enzim yang termasuk dalam golongan ini dapat dibagi dalam dua bagian yaitu dehidrogenase dan oksidase. Dehidrogenase bekerja pada reaksireaksi dehidrogenasi, yaitu reaksi pengambilan atom Hidrogen dari suatu senyawa (donor). Hidrogen yang dilepas akan diterima oleh senyawa lain (akseptor). Enzim-enzim oksidase juga bekerja sebagai katalis pada reaksi pengambilan hidrogen pada suatu sunstrat. Dalam reaksi ini yang bertindak sebagai akseptor hidrogen adalah oksigen.
Transferase
Enzim yang termasuk golongan ini bekerja sebagai katalis pada reaksi pemindahan suatu gugus dari suatu senyawa kepada senyawa lain. Beberapa enzim yang termasuk golongan ini ialah metiltransferase, hidroksimetiltransferase, karboksiltransferase, asiltransferase dan amino
transferase atau disebut juga transaminase.
Hidrolase
Enzim yang termasuk kelompok ini bekerja sebagai katalis pada reaksi hidrolisis. Ada tiga fungsi hidrolase yaitu memecah ikatan ester, memecah glikosida dan memecah ikatan peptida. Beberapa enzim sebagai contoh ialah esterase, lipase, fosfotase, amilase dan protease. Esterase adalah enzim yang memecah ikatan ester dengan cara hidrolisis. Esrterase yang terdapat dalam hati dapat memecah ester sederhana, misalnya etil butirat menjadi etanol dan asam butirat.
Enzim amilase digunakan untuk menghidrolisis pati menjadi suatu produk yang larut dalam air serta mempunyai berat molekul rendah yaitu glukosa. Enzim ini banyak digunakan pada industri minuman misalnya pembuatan high fructose syrup (HFS) maupun pada industri tekstil. Enzim amilase dapat diproduksi oleh berbagai jenis mikroorganisme terutama keluarga Bacillus, Pseudomonas dan Clostridium. Bakteri potensial yang akhir-akhir ini banyak digunakan untuk memproduksi enzim amilase pada skala industri antara lain Bacillus licheniformis dan Bacillus stearothermophillus. Bahkan penggunaan Bacillus stearothermophillus lebih disukai karena mampu menghasilkan enzim yang bersifat termostabil sehingga dapat menekan biaya produksi. Enzim proteolitik memainkan peranan yang penting pada industri makanan (misalnya dalam proses konversi susu menjadi keju), sebagai bahan pada deterjen maupun pada pemrosesan kulit. Protease yang dipakai secara komersial seperti serine protease dan metalloprotease, biasanya berasal dari Bacilus subtilis yang mempunyai kemampuan produksi dan sekskresi enzim yang tinggi. Pemakaian enzim protease dalam proses tanning kulit dapat meningkatkan kualitas kulit, disamping itu juga merupakan pemakaian produk bioteknologi yang ramah lingkungan karena dapat mengurangi beban polusi limbah industri kulit.
Enzim lipase banyak diproduksi oleh berbagai jenis mikroorganisme baik tunggal maupun bersamaan dengan enzim esterase. Mikroba penghasil lipase antara lain adalah Pseudomonas aeruginosa, Serratia marcescens dan Bacilus subtilis. Enzim lipase ini digunakan sebagai biokatalis untuk memproduksi asam lemak bebas, gliserol, berbagai ester, sebagian trigliserida, dan lemak yang dimodifikasi atau diesterifikasi dari substrat yang murah, seperti minyak kelapa sawit. Produk-produk tersebut secara luas digunakan dalam industri farmasi, kimia, dan makanan.
Liase
Enzim yang termasuk golongan ini mempunyai peranan penting dalam reaksi pemisahan suatu gugus dari suatu substrat (bukan cara hidrolisis) atau sebaliknya. Contoh enzim golongan ini antara lain dekarboksilase, aldolase, hidratase.
Isomerase
Enzim yang termasuk golongan ini bekerja pada reaksi perubahan intramolekuler, misalnya reaksi perubahan glukosa menjadi fruktosa, perubahn senyawa L menjadi senyawa D, senyawa cis menjadi senyawa trans dan lain-lain.
Ligase
Enzim yang termasuk golongan ini bekerja pada reaksi-reaksi penggabungan dua molekul. Oleh karenanya enzim-enzim tersebut juga dinamakan sintetase. Ikatan yang terbentuk dari penggabungan tersebut adalah ikatan C-O, C-S, C- N atau C-C. Contoh enzim golongan ini adalah lutamine sintetase dan piruvat karboksilase (Suhartono MT, 2000).