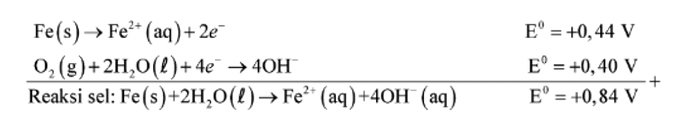-
Pengertian
Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Contoh korosi yang paling lazim adalah perkaratan besi.
Pada peristiwa korosi, logam mengalami oksidasi, sedangkan oksigen (udara) mengalami reduksi. Karat logam umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat-merah.
Korosi merupakan proses elektrokimia. Pada korosi besi, bagian tertentu dari besi itu berlaku sebagai anode, di mana besi mengalami oksidasi. Elektron yang dibebaskan di anode mengalir ke bagian lain dari besi itu yang bertindak sebagai katode, di mana oksigen tereduksi.
Ion besi(II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion besi(III) yang kemudian membentuk senyawa oksida terhidrasi, yaitu karat besi. Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan rapatan logam itu. -
Mekanisme Terjadinya Korosi
Klasifikasi menurut mekanisme terjadinya dibagi dua:- Korosi Basah, temperatur rendah (low temperature corrosion/wet corrosion/electrochemical corrosion)
Reaksi Elektrokimia
Misalnya : korosi di media yang mengandung uap air atau air atau di media elektrolit - Korosi Kering, temperatur tinggi (high temperature corrosion/dry corrosion/chemical corrosion/ oxidation)
Reaksi Kimia
Misalnya : korosi pada ruang bakar, sudu turbin gas
- Korosi Basah, temperatur rendah (low temperature corrosion/wet corrosion/electrochemical corrosion)
-
Faktor yang Berpengaruh Pada Korosi
- Reaksi atau Proses : Redoks,pasivasi,polarisasi
- Media atau lingkungan : Oksigen atau oksider, agitasi atau pengadukan, temperatur, konsentrasi, pH, bakteri, dan sebagainya
- Metalurgi logam : komposisi, struktur mikro, dan impurities
-
Bentuk-Bentuk Korosi
- Uniform/general corrosion
Korosi jenis ini yang paling sering, umum dijumpai. Korosi ini dikontrol oleh reaksi kimia atau elektrokimia antara permukaan logam dengan media korosifnya. - Galvanik/bimetal corrosion
Bila dua logam yang berbeda saling kontak dan berada pada media/larutan yang konduktif dan korosif maka akan timbul “beda potensial” yang menyebabkan terjadinya aliran arus listrik atau perpindahan elektron. - Crevice Corrosion (korosi celah)
Merupakan salah satu jenis korosi lokal. Korosi ini disebabkan oleh adanya sejumlah kecil sekali larutan yang ter-stagnasi (diam), karena adanya hole, gasket. - Pitting Corrosion (korosi sumuran)
- Korosi lokal
Korosi yang menyerang pada logam yang :
a. selaput pelindungnya robek secara mekanik.
b. memiliki tegangan konsentrasi lokal.
c. memiliki konsentrasi kimia heterogen (inklusi, segregasi , presipitasi) - Intergranular Corrosion (korosi batas butir)
Korosi ini sering disebut : Intergranular Attact (IGA), Intergranular Corr (IGC) - Selective Leaching
- Errosion Corrosion
- Stress Corrosion
- Uniform/general corrosion
-
Proses Terjadinya Korosi
Karat terjadi karena adanya tiga komponen yang membuat adanya reaksi kimia, yaitu zat besi, air, dan oksigen. Karat yang dialami oleh logam, seperti besi dan baja terjadi karena adanya reaksi kimia yang disebut proses elektrokimia atau korosi, yang menyebabkan kerusakan di permukaan besi.
Saat air mengenai besi, maka air akan tercampur dengan karbon di udara yang kemudian membentuk asam karbonat. Asam yang terbentuk ini akan membuat zat besi pada logam menjadi larut. Sedangkan sebagian air akan mulai terurai jadi dua komponen yang berbeda, yaitu hidrogen dan oksigen. Hidrogen dan oksigen yang tercampur dengan atom pada besi inilah yang kemudian menyebabkan karat muncul di permukaan besi. Akibat dari proses ini, maka terbentuklah senyawa kimia baru yang membentuk oksida besi atau karat. -
Tindakan Preventif
- Pengecatan
Pengecatan berfungsi untuk melindungi besi dari kontak dengan air dan udara. Cat yang mengandung timbal dan seng akan lebih melindungi besi terhadap korosi. Pengecatan harus sempurna karena jika terdapat bagian yang tidak tertutup oleh cat, maka besi di bawah cat akan terkorosi. Pagar bangunan dan jembatan biasanya dilindungi dari korosi dengan pengecatan. - Dibalut plastik
Plastik mencegah terjadinya kontak besi dengan air dan udara. Peralatan rumah tangga biasanya dibalut plastik untuk menghindari korosi. - Pelapisan dengan krom (Cromium plating)
Krom memberi lapisan pelindung, sehingga besi yang dikrom akan menjadi mengkilap. Cromium plating dilakukan dengan proses elektrolisis. Krom dapat memberikan perlindungan meskipun lapisan krom tersebut ada yang rusak. Cara ini umumnya dilakukan pada kendaraan bermotor, misalnya bumper mobil. - Pelapisan dengan timah (Tin plating )
Timah termasuk logam yang tahan karat. Kemasan kaleng dari besi umumnya dilapisi dengan timah. Proses pelapisan dilakukan secara elektrolisis atau electroplating. Lapisan timah akan melindungi besi selama lapisan itu masih utuh. Apabila terdapat goresan, maka timah justru mempercepat proses korosi karena potensial elektrode besi lebih positif dari timah. - Pelapisan dengan seng (Galvanisasi)
Seng dapat melindungi besi meskipun lapisannya ada yang rusak. Hal ini karena potensial elektroda besi lebih negatif daripada seng, maka besi yang kontak dengan seng akan membentuk sel elektrokimia dengan besi sebagai katode. Seng akan mengalami oksidasi sehingga besi akan lebih awet. - Pengorbanan anode (Sacrificial Anode)
Perbaikan pipa bawah tanah yang terkorosi mungkin memerlukan perbaikan yang mahal biayanya. Hal ini dapat diatasi dengan teknik sacrificial anode, yaitu dengan cara menanamkan logam magnesium kemudian dihubungkan ke pipa besi melalui sebuah kawat. Logam magnesium itu akan berkarat, sedangkan besi tidak karena magnesium merupakan logam yang aktif .
- Pengecatan
-
Tindakan Penanggulangan
Tindakan penanggulangan atau tindakan yang bisa kita lakukan ketika logam besi sudah mengalami perkaratan adalah dengan menggunakan bahan-bahan sebagai berikut :
a. Cuka
b. Baking soda
c. Lemon dan garam
d. Sabun pencuci piring dan kentang
e. Asam sitrat
Penyusun artikel :
Kelompok 5
- Fischa Indaya B.
- Khoilifa Rahma S.
- Rifqi Satya