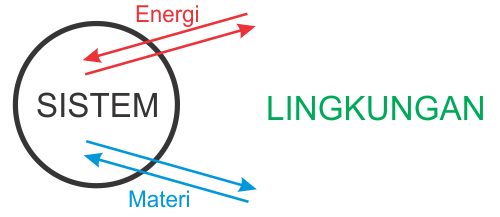
Bagaimana Interasksi Materi dengan Energi pada Dasar-dasar Spektrofotometri UV/Vis?

Bagaimana Interasksi Materi dengan Energi pada Dasar-dasar Spektrofotometri UV/Vis?
Cahaya dapat dipandang sebagai bentuk gelombang dan sebagai foton yang mempunyai energi (E) sebesar : E = H.u, dimana H adalah tetapan Plank (6,6 x 10-27Erg) dan u adalah frekuensi.
Coba perhatikan gambar berikut di bawah ini.
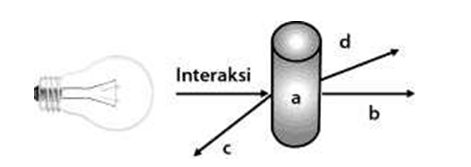
Jika suatu energi cahaya mengenai suatu materi maka akan ada beberapa kemungkinan, yaitu
Absorpsi radiasi cahaya oleh materi terjadi karena adanya transisi tingkat energi elektronik (UV-Vis), tingkat energi vibrasi (IR), tingkat energi rotasi (gelombang mikro), induksi magnet dengan ekspos inti atau elektron pada medan magnet (NMR/ESR, Gelombang radio/mikro).
Spektrometri ultraviolet/sinar tampak menyangkut absorpsi sinar ultraviolet/sinar tampak oleh molekul yang menyebabkan promosi elektron dari keadaan dasar ( ground state ) ke keadaan tereksitasi ( exited state ). Umur keadaan tereksitasi ini sangat pendek, yaitu 10-8 – 10-9 detik dan molekul kembali ke keadaan dasar lagi. Absorpsi sinar ultraviolet dan sinar tampak pada umumnya menghasilkan eksitasi elektron bonding sehingga panjang gelombang absorpsi maksimum dapat dikorelasikan terhadap jenis ikatan yang terdapat di dalam molekul yang dianalisis. Spektrometri ultraviolet dan sinar tampak berguna pada penentuan gugus fungsi senyawa organik dan analisis kuantitatif.
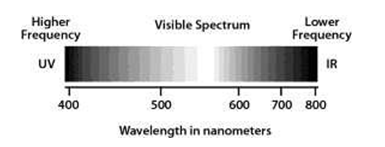
Radiasi sinar ultraviolet/sinar tampak berada pada panjang gelombang (lamda) antara 180 dan 780 nm.
Daerah Radiasi Sinar Tampak (Visibel)
Molekul/ion zat organik juga sejumlah anion anorganik dapat mengabsorpsi sinar ultraviolet dan sinar tampak karena mengandung elektron-elektron ikatan (elektron valensi) di orbital molekul paling luar yang dieksitasikan ke tingkat energi yang lebih tinggi. Eksitasi tersebut disertai pula oleh transisi tingkat energi vibrasi dan tingkat energi rotasi. Transisi pada sinar tampak tidak sejauh transisi pada sinar ultraviolet.
Energi yang diperlukan untuk mengeksitasikan elektron membentuk ikatan tunggal sangat tinggi sehingga sinar ultraviolet yang dapat diserap oleh molekul berikatan tunggal adalah sinar ultraviolet yang berenergi tinggi (panjang gelombangnya pendek), yaitu < 180 nm (sinar violet vakum). Sinar ultraviolet ini dapat diserap oleh komponen-komponen udara sehingga spektrometer yang digunakan pada pengukuran ini harus divakumkan (sulit untuk dilakukan). Akibatnya penyelidikan senyawa organik hanya dilakukan pada panjang gelombang > 180 nm.
Penyerapan sinar ultraviolet yang panjang gelombangnya > 180 nm dan penyerapan sinar tampak (380 – 780 nm) dilakukan oleh senyawa-senyawa yang mempunyai gugus-gugus fungsi yang disebut kromofor. Gugus kromofor ini mempunyai elektron valensi dengan energi eksitasi yang relatif rendah.