Perkembangan Teori Atom
Setiap benda, misalnya garam dapur ditumbuk sampai halus maka sifat-sifat butir yang terkecil sekalipun masih serupa dengan sifat-sifat garam semula, hanya ukurannya yang berubah. Apabila proses pemecahannya diteruskan hasilnya tetap mempunyai sifat-sifat garam. Bahkan apabila butir-butir itu dilarutkan dalam air maka rasa asin masih tetap ada. Butir-butir terkecil yang telah larut dalam air tidak tampak oleh indra biarpun dengan mikroskop sekalipun.
Butir-butir garam dapur yang paling kecil ini semula disebut partikel. Dengan demikian, setiap materi garam dapur yang kita kenal terdiri dari kumpulan partikel garam dapur yang jumlahnya banyak sekali. Setiap materi bukan merupakan satu kesatuan, tetapi merupakan kumpulan dari partikel-partikel yang sangat banyak. Oleh karena partikel-partikel itu terdiri dari satu kesatuan maka berarti setiap materi terdiri dari bagian-bagian yang diskontinu (terputus-putus).
Pemikiran ini mendasari pengertian tentang atom yang telah mengalami perkembangan yang cukup lama. Perkembangan ini dimulai sejak para ahli filsafat Yunani bernama Demokritus (460-370 SM) merumuskan gagasan bahwa zat dapat dibagi atas bagian-bagian yang lebih kecil sampai mencapai satu bagian yang paling kecil yang tidak dapat dibagi lagi. Bagian zat yang tidak dapat dibagi lagi ini disebut atom, yang berasal dari kata Yunani atomos, artinya tak dapat dibagi lagi. Konsepsi tentang atom yang dikemukakan oleh Demokritus ini berdasarkan hasil pemikiran bukan berdasarkan hasil eksperimen. Konsepsi ini pertama kali dikembangkan oleh Leukipos salah seorang murid Demokritus dan sampai sekarang masih diakui kebenarannya. Leukipos berkesimpulan bahwa alam semesta ini hanya terdiri dari ruangan yang berisi atom-atom saja.
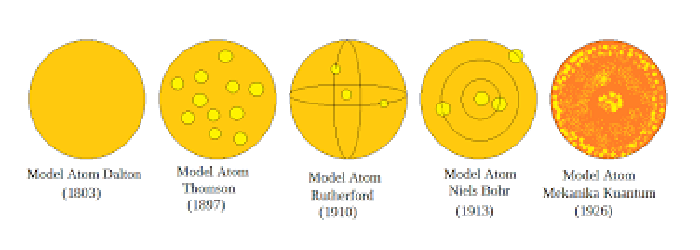
Selama + 2000 tahun teori tentang atom dari Demokritus dan Leukipos ini tidak berkembang sama sekali karena orang masih percaya kepada Aristoteles yang tidak membenarkan konsep tentang atom ini. Baru pada abad ke-18 para ilmuwan mulai percaya karena konsep ini mempunyai relevansi dengan proses fisika dan proses kimia yang mulai berkembang. Gagasan tentang atom dan bagian terkecil dari pada zat dipelajari lagi. Pada tahun 1802 John Dalton telah melakukan percobaan-percobaan yang menunjang pertumbuhan pengertian tentang atom, yang mencoba menerangkan reaksi-reaksi kimia antara zat-zat. Teori atom Dalton sebagai berikut.
-
Atom merupakan partikel terkecil yang tidak dapat dibagi lagi.
-
Atom suatu unsur tidak dapat berubah menjadi unsur atom lain. Misalnya, atom unsur besi tidak dapat berubah menjadi atom unsur lain. seperti emas. Atom unsur lain semuanya serupa.
-
Dua buah atom atau lebih yang berasal dari unsur-unsur yang berlainan dapat bersenyawa membentuk molekul.
Misalnya, atom-atom hidrogen dan oksigen bersenyawa membentuk molekul air (H2O). Jadi, molekul suatu zat dapat dibagi atas atom dan molekul yang masih mempunyai sifat seperti zat asalnya.
-
Atom-atom yang bersenyawa dalam molekul, mempunyai perbandingan tertentu dan jumlah massa keseluruhannya tetap. Jumlah massa sebelum reaksi sama dengan jumlah massa sesudah reaksi.
-
Apabila dua macam atom membentuk dua macam senyawa atau lebih maka atom-atom yang sama dalam kedua senyawa itu mempunyai perbandingan yang sederhana.
Misalnya, unsur karbon dan unsur oksigen dapat bersenyawa membentuk molekul CO dan CO2. Atom C pada CO dengan atom C pada CO2 mempunyai perbandingan yang sederhana.
Dewasa ini teori atom mengalami perkembangan yang pesat dan dalam beberapa hal tidak sesuai lagi dengan teori atom Dalton bahwa atom tidak dapat dibagi ternyata bertentangan dengan eksperimen-eksperimen. Hasil eksperimen menunjukkan, atom masih terbagi lagi menjadi partikel-partikel yang lebih kecil, seperti proton, neutron, dan elektron. Inti atom suatu unsur dapat berubah menjadi inti atom unsur lain. Hal ini dapat Anda pelajari pada bab berikutnya.
Teori atom Dalton hanya cocok dengan percobaan-percobaan yang dilakukan pada saat itu. Untuk membuktikan kebenaran suatu teori perlu adanya konsistensi dengan fakta dan harus menunjukkan bahwa teori itu adalah suatu teori yang cocok. Apabila ada dua teori yang memenuhi kedua syarat tadi maka akan dipilih yang lebih sederhana, dan dapat menerangkan gejala-gejala yang lebih banyak atau yang berlaku lebih umum. Teori bukanlah sesuatu yang mutlak, tetapi merupakan rencana atau pembimbing selama bekerja.
Walaupun para ilmuwan pada abad kesembilan belas menerima gagasan bahwa unsur kimia terdiri dari atom-atom, mereka tidak mengetahui tentang atom itu sendiri. Penemuan elektron oleh Thomson pada tahun 1897 dan pengetahuan bahwa semua atom mengandung elektron membuat pandangan yang penting mengenai struktur atomik. Elektron mengandung muatan listrik negatif, sedangkan atom muatan listriknya netral, jadi setiap atom harus mengandung cukup materi bermuatan positif untuk mengimbangi muatan negatif elektron-elektronnya. Elektron beribu kali lebih ringan dari atom keseluruhan. Hal ini menimbulkan dugaan bahwa bagian materi bermuatan positif dari atom menentukan hampir seluruh massa atom. Pada tahun 1895 ditemukan pula adanya partikel-partikel bermuatan listrik positif.
Atas dasar penemuan tersebut, pada tahun 1904 Thomson menyusun suatu model atom yang berbeda dengan model atom Dalton. Menurut Thomson, sebuah atom mempunyai muatan-muatan listrik positif yang tersebar merata di seluruh bagian atom, yang dikenal dengan model kue atom Thomson.
Tiga belas tahun kemudian uji eksperimen model kue atom Thomson dilakukan oleh Ernest Rutherford seorang ahli fisika Inggris. Ia mengadakan percobaan dengan menembak atom-atom pada sebuah keping emas yang sangat tipis, dengan partikel-partikel alfa. Partikel alfa adalah atom Helium yang kehilangan dua elektron sehingga yang tertinggal ialah partikel bermuatan +2e. Hasil eksperimen yang diperoleh memaksa kita untuk meninggalkan model atom Thomson.
Jauh pada masa lalu manusia telah menduga bahwa materi walaupun kelihatannya kontinu, memiliki struktur tertentu pada tingkat mikroskopik di luar jangkauan indra kita. Dugaan ini tidak mengambil bentuk yang nyata sampai kira-kira satu setengah abad yang lalu, pada saat keberadaan atom dan molekul, partikel materi dasar dalam bentuk yang lazim telah dapat ditunjukkan dan partikel dasar dari atom dan molekul, yaitu elektron, proton dan neutron telah teridentifikasi dan telah dipelajari.
Setiap atom terdiri dari sebuah inti kecil yang terdiri dari proton dan neutron, serta sebuah elektron pada jarak yang lebih jauh. Dalam pikiran kita terdapat gambaran bahwa elektron berputar mengelilingi inti, seperti planet mengelilingi matahari. Akan tetapi, menurut teori elektromagnetik klasik, menolak kemungkinan terdapatnya orbit elektron yang mantap. Dalam usaha untuk memecahkan kesukaran ini pada tahun 1913 Niels Bohr menerapkan gagasan kuantum. Pada struktur atomik untuk mendapatkan model yang tetap dan memudahkan gambaran karakteristik atom. Model ini ternyata terdapat kekurangan dan harus diganti dengan pemerian mekanika kuantum supaya didapatkan ketelitian dan kegunaan yang lebih besar. Teori Bohr mengenai atom hidrogen sangat berharga untuk dipelajari karena teori itu memberikan gambaran dan menyiapkan transisi yang berharga menuju teori kuantum atom yang lebih abstrak.