Dalam kamus kedokteran terdapat istilah P53. Apa arti dari istilah tersebut?
P53 adalah gen supresor tumor yang bertindak menghentikan perkembangan tumor. Hal ini dilakukan dengan mengaktifkan beberapa protein yang memicu kematian sel-sel yang rusak sehingga sel-sel tersebut tidak mereplikasi dan membelah tak terkendali.
P53 merupakan tumor suppressor gene yang multifungsi dan sering mengalami alterasi pada kanker ovarium dan jenis kanker lainnya. Pada kondisi normal, P53 berinteraksi dengan berbagai jenis protein yang terlibat dalam regulasi transkripsional, repair DNA, siklus sel, apoptosis, dan degradasi protein yang dimediasi oleh proteosom. Dalam kondisi normal, jaringan P53 dalam kondisi tidak aktif, biasanya diaktifkan oleh semacam stress seluler yang dapat mengubah siklus pertumbuhan sel normal atau menginduksi mutasi genom yang kemudian mengarah pada tranformasi onkogenik.
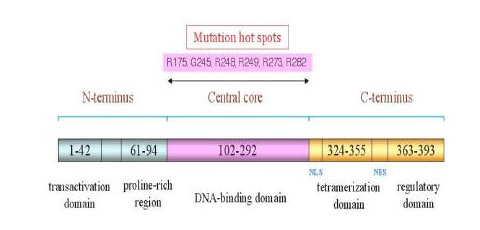
Gen P53 terletak pada bagian lengan pendek dari kromosom 17 (17p13.1), merupakan suatu nuklear phospoprotein yang memiliki berat molekul sebesar 53 kilo Dalton (kDa). Gen P53 ini dikode oleh 20 kilobasa (kb) yang terdiri dari 11 ekson dan 10 29 intron. Gen p53 ini termasuk di dalam kelompok gen pelindung sel, yang memiliki dua anggota lainnya yaitu, p63 dan p73. Protein P53 wild type (wt p53), mengandung sebanyak 393 asam amino dan terdiri dari tiga domain fungsional yaitu N-terminal activation domain, DNA binding domain dan C-terminal tetramerization domain . Selain itu, terdapat sebuah daerah domain inti sentral atau central core, yaitu pada residu 102 sampai 292 dan daerah domain Cterminal, yaitu pada residu 324 sampai 393.
Berikut ini merupakan gambar Representasi Skematik Struktur P53
Apa itu P53 ?
SEJARAH PENEMUAN
P53 diidentifikasi pada tahun 1979 melalui hubungannya dengan simian virus 40 (SV-40) antigen T besar dalam sel kanker yang ditransformasikan secara virus oleh Lionel Crawford , David P. Lane , Arnold Levine , dan Lloyd Old , bekerja di Imperial Cancer Research Fund (Inggris) Universitas Princeton / UMDNJ (Institut Kanker New Jersey), dan Memorial Sloan-Kettering Cancer Center , masing-masing. Selama dekade pertama setelah penemuannya, protein TP53 dianggap dikodekan oleh proto-onkogen karena pengaruhnya terhadap peningkatan pertumbuhan sel dan kelangsungan hidup ketika diekspresikan secara paksa dalam garis sel. Sekarang diketahui bahwa penelitian awal ini yang menggambarkan fungsi TP53 secara tidak sengaja dilakukan pada gen Tp53 mutan daripada bentuk tipe liar ( Levine dan Oren 2009).). Realisasi perannya sebagai penekan tumor berasal dari sejumlah pengamatan penting. Pada tahun 1989, gen Tp53 diidentifikasi sebagai target penghapusan kromosom 17p yang sering terjadi kembali yang diamati pada karsinoma kolorektal manusia ( Baker et al. 1989 ) dengan> 50% tumor ini menyimpan mutasi missense pada alel Tp53 yang tersisa .
Awalnya dianggap sebagai onkogen karena penggunaan cDNA bermutasi setelah pemurnian mRNA sel tumor . Perannya sebagai gen penekan tumor terungkap pada tahun 1989 oleh Bert Vogelstein di Fakultas Kedokteran Johns Hopkins dan Arnold Levine di Universitas Princeton. Warren Maltzman, dari Waksman Institute of Rutgers University pertama kali menunjukkan bahwa TP53 responsif terhadap kerusakan DNA dalam bentuk radiasi ultraviolet. Dalam serangkaian publikasi pada 1991-1992, Michael Kastan dari Johns Hopkins University , melaporkan bahwa TP53 adalah bagian penting dari jalur transduksi sinyal yang membantu sel merespons kerusakan DNA. Pada tahun 1993, p53 terpilih sebagai molekul terbaik tahun ini oleh majalah Science .
“Protein TP53 pertama kali ditemukan pada tahun 1979 ( DeLeo et al. 1979 ; Lane dan Crawford 1979 ; Linzer dan Levine 1979 “.
APA ITU P53 ?
Tumor Protein 53, atau disebut juga dengan p53 adalah suatu gen yang menyediakan instruksi untuk membuat protein yang disebut protein tumor p53 (atau p53). Protein ini bertindak sebagai penekan tumor, yang berarti ia mengatur pembelahan sel dengan menjaga sel agar tidak tumbuh dan membelah (berkembang biak) terlalu cepat atau dengan cara yang tidak terkontrol. Protein p53 terletak di inti sel di seluruh tubuh, di mana ia menempel (mengikat) langsung ke DNA.
Ketika DNA dalam sel menjadi rusak oleh agen seperti bahan kimia beracun, radiasi, atau sinar ultraviolet (UV) dari sinar matahari, protein ini memainkan peran penting dalam menentukan apakah DNA akan diperbaiki atau sel yang rusak akan hancur sendiri (mengalami apoptosis). Jika DNA dapat diperbaiki, p53 mengaktifkan gen lain untuk memperbaiki kerusakan. Jika DNA tidak dapat diperbaiki, protein ini mencegah sel membelah dan memberi sinyal untuk menjalani apoptosis. Dengan menghentikan sel-sel dengan DNA bermutasi atau rusak membelah, p53 membantu mencegah perkembangan tumor. Karena p53 sangat penting untuk mengatur perbaikan DNA dan pembelahan sel, ia dijuluki “penjaga genom.”
Gen p53 seperti gen Rb, adalah gen penekan tumor. Aktivitasnya menghentikan pembentukan tumor. Jika seseorang mewarisi hanya satu salinan fungsional gen p53 dari orang tua mereka, mereka cenderung terkena kanker dan biasanya mengembangkan beberapa tumor independen dalam berbagai jaringan di awal masa dewasa. Kondisi ini jarang terjadi, dan dikenal sebagai sindrom Li-Fraumeni. Namun, mutasi pada p53 ditemukan pada sebagian besar jenis tumor, dan berkontribusi pada jaringan kompleks peristiwa molekuler yang mengarah pada pembentukan tumor.
Gen p53 telah dipetakan ke kromosom 17. Di dalam sel, protein p53 mengikat DNA, yang pada gilirannya menstimulasi gen lain untuk menghasilkan protein yang disebut p21 yang berinteraksi dengan protein stimulasi pembelahan sel (cdk2). Ketika p21 kompleks dengan cdk2 sel tidak bisa melewati ke tahap pembelahan sel berikutnya. P53 mutan tidak dapat lagi mengikat DNA dengan cara yang efektif, dan sebagai konsekuensinya protein p21 tidak tersedia untuk bertindak sebagai ‘sinyal berhenti’ untuk pembelahan sel. Dengan demikian sel membelah tanpa terkendali, dan membentuk tumor.
P53 adalah SUATU PROTEIN SEBAGAI GEN SUPRESOR TUMOR juga dapat disebut:
-
seluler tumor antigen p53 ( UniProt nama);
-
Guardian dari Genome ;
-
phosphoprotein p53 ;
-
penekan tumor p53 ;
-
antigen NY-CO-13 ;
-
transformasi terkait protein 53 (TRP53) .
Semua sebutan daiatas adalah segala isoform dari protein yang dikodekan oleh gen homolog dalam berbagai organisme, seperti TP53 (manusia) dan Trp53 (tikus). Homolog ini (awalnya dianggap, dan sering disebut sebagai, protein tunggal) sangat penting dalam vertebrata multiseluler , di mana ia mencegah pembentukan kanker , dan dengan demikian berfungsi sebagai penekan tumor. Dengan demikian, p53 telah digambarkan sebagai "penjaga genom " karena perannya dalam menjaga stabilitas dengan mencegah mutasi genom. Oleh karena itu TP53 diklasifikasikan sebagai gen penekan tumor.
Pada manusia, gen TP53 terletak di lengan pendek kromosom 17. Gen ini berukuran 20 kb, dengan ekson non-coding 1 dan intron pertama yang sangat panjang yaitu 10 kb. Urutan pengkodean berisi lima wilayah yang menunjukkan tingkat konservasi tinggi pada vertebrata, terutama di ekson 2, 5, 6, 7 dan 8, tetapi urutan yang ditemukan pada invertebrata hanya menunjukkan kemiripan yang jauh dengan TP53 mamalia. TP53 ortolog telah diidentifikasi di sebagian besar mamalia yang tersedia data genom lengkap.
Protein TP53 sebagai penekan tumor kritis yang memainkan peran mendasar dan beragam dalam pengembangan terapi kanker dan kanker. Meskipun penelitian lebih dari 30 tahun dan literatur yang luas, mekanisme molekuler yang mendasari fungsi penekan tumor TP53 belum ditentukan dan tetap menjadi fokus penyelidikan aktif. Memahami fungsi penekan tumor dari gen Tp53 tidak hanya akan sangat penting bagi pemahaman biologi kanker tetapi juga akan berdampak pada terapi kanker dan pencegahan melalui peningkatan eksploitasi Tp53 tipe liar. fungsi serta memperoleh wawasan tentang kerentanan spesifik yang dikenakan pada tumor dengan hilangnya fungsi TP53. Protein TP53 memberikan fungsi efektor yang berdampak pada hampir semua ciri khas kanker ( Hanahan dan Weinberg 2011 ); Namun, masih belum jelas fungsi mana yang penting untuk fungsi penekan tumor yang kuat dan bagaimana fungsi ini berinteraksi. Memang, menjadi semakin jelas bahwa banyak jalur kemungkinan untuk berkolaborasi dalam mengerahkan fungsi penekan tumor ini dan bahwa protein TP53 memiliki peran konteks spesifik.
Tingginya frekuensi inaktivasi Tp53 sangat menyarankan fungsi penekan tumornya. Selain itu, pada tahun yang sama, ditunjukkan bahwa ekspresi yang dipaksakan dari protein TP53 tipe liar dapat memblokir transformasi yang dimediasi onkogen dari fibroblas embrionik tikus primer dalam kultur. Peran protein TP53 dalam penekanan tumor telah dibuktikan secara eksperimental dan diteliti lebih lanjut menggunakan model tikus yang dihasilkan oleh penargetan gen. Mengkonfirmasi fungsi penekan tumor dari gen Tp53 , tikus knockout Tp53 ( Tp53 - / - ) dengan mutasi kehilangan fungsi di Tp53 mengembangkan tumor spontan dengan insiden 100% pada usia 9 bulan ( Donehower et al. 1992 ; Jacks et al. 1994 ; Lang et al. 2004 ; Olive et al. 2004 ).
Menariknya, latar belakang genetik mempengaruhi spektrum tumor: Tp53 - / -tikus dengan latar belakang C57BL / 6 sebagian besar mengembangkan limfoma thymus, sedangkan sarkoma, hemangioma, limfoma sel-B, dan kanker payudara dapat timbul pada 129SV, BALB / c, atau latar belakang genetik campuran . The TP53 - / - tikus juga memiliki peningkatan kerentanan terhadap karsinogen dan perkembangan tumor-iradiasi-induced γ ( Harvey et al 1993b. ; Kemp et al 1994. , Konsisten dengan peran penting dari protein TP53 dalam respon seluler untuk DNA) kerusakan. Inaktivasi jalur TP53 juga dapat secara nyata mempercepat perkembangan tumor yang digerakkan oleh onkogen ( Eischen et al. 1999; Schmitt et al. 1999 ; Michalak et al. 2009 ).
Selain mencegah pembentukan tumor spontan, protein TP53 memberikan efek penekan tumor yang kuat pada tumor yang kekurangan TP53 . Restorasi yang dapat diinduksi dari protein TP53 tipe-liar pada tumor-tumor mapan yang telah ditimbulkan oleh hilangnya fungsi TP53 mengarah pada regresi tumor dan kelangsungan hidup yang berkelanjutan dari tikus-tikus yang terbebani tumor ( Martins et al. 2006 ; Ventura et al. 2007 ; Xue et al. 2007). TP53 fungsional pada tumor tersebut in vivo menunjukkan ketergantungan konteks dramatis, dengan induksi apoptosis pada limfoma tetapi penuaan seluler pada sarkoma. Ini mungkin berhubungan dengan jenis sel yang ditransformasikan atau sifat lesi onkogenik yang mendorong transformasi mereka (di samping hilangnya TP53). Apapun, studi ini menegaskan fungsi penekan tumor TP53 in vivo.
Pentingnya gen Tp53 sebagai penekan tumor disorot dalam kanker manusia di mana itu adalah gen yang paling sering bermutasi, dengan mutasi ditemukan dalam berbagai jenis kanker . Lebih lanjut, pada kanker di mana gen Tp53 tetap utuh, fungsi TP53 sering terganggu, misalnya, dengan gangguan dari protein virus atau regulasi regulator negatif, seperti E3 ubiquitin ligase, MDM2 (disebut HDM2 pada manusia) ( Vogelstein et al. 2000 ). Dengan demikian, sebagian besar kanker manusia mengandung perubahan genetik atau epigenetik yang merusak jalur TP53.
Persyaratan untuk fungsi TP53 normal dalam penekanan tumor terlihat jelas pada keluarga dengan sindrom Li-Fraumeni, yang rentan terhadap pembentukan tumor spontan. karena pewarisan mutasi kehilangan fungsi germline dalam satu alel Tp53 . Pasien sindrom Li-Fraumeni biasanya mengembangkan kanker sebelum usia 45 tahun, yang paling sering muncul sebagai jaringan lunak atau sarkoma bertulang, kanker payudara, tumor otak, karsinoma korteks adrenal, atau leukemia. Namun, dengan studi epidemiologi yang lebih besar, sekarang jelas bahwa keluarga yang terkena mungkin memiliki rentang yang lebih luas dari keganasan dan usia onset, dengan individu langka bahkan tetap bebas tumor dan mengalami umur panjang, menyoroti kompleksitas jaringan penekan tumor TP53 ( Kamihara). et al. 2014 ). Dalam contoh yang informatif, sekelompok kasus karsinoma korteks adrenal masa kanak-kanak diamati di Brasil Selatan ( Ribeiro et al. 2001 ; Achatz et al. 2007) mengarah pada penemuan mutasi, R337H, yang menghasilkan ketidakstabilan tergantung-pH tetramer TP53 dan perkembangan tumor yang dibatasi jaringan. Studi tentang penyakit manusia terus memberikan wawasan penting tentang fungsi protein TP53.
Akumulasi pengetahuan tentang fungsi penekan tumor TP53 dari lebih dari 30 tahun penelitian telah memuncak dalam eksploitasi untuk pengobatan kanker manusia. Terapi yang ditargetkan ditujukan untuk secara khusus meningkatkan, atau memulihkan, fungsi TP53 telah terbukti efektif dalam memunculkan regresi tumor dalam model praklinis, misalnya, dengan menggunakan inhibitor molekul kecil yang memblokir E3 ubiquitin ligase, MDM2 (HDM2), yang merupakan regulator negatif utama dari TP53 ( Vassilev 2005 ; Brown et al. 2009 ).
PERSYARATAN UNTUK SUPPRESI TUMOR MEDIASI TP53
Deteksi dan Respons terhadap Stres Onkogenik
Penekan tumor TP53 dapat diaktifkan oleh beragam tekanan seluler, termasuk ekspresi onkogen, kerusakan DNA, hipoksia, disfungsi metabolisme, dan stres replikasi, yang kemudian menerapkan respons yang tepat untuk menentang inisiasi kanker. Aktivasi protein TP53 dapat menghasilkan berbagai respons seluler, termasuk apoptosis, penuaan sel, penghentian siklus sel, perbaikan DNA, adaptasi metabolik, dan perubahan pada karakteristik seluler, seperti keadaan diferensiasi. Nasib sel setelah aktivasi TP53 ditentukan oleh jenis, durasi, dan amplitudo sinyal stres serta konteks di mana ia terjadi, seperti jenis sel.Hasilnya dimodulasi oleh interaksi dengan jalur pensinyalan lain yang aktif.
Selain itu, protein TP53 memberikan kontrol substansial terhadap homeostasis seluler dalam kondisi mapan, bahkan sebelum “aktivasi” oleh sinyal stres. Pengendalian aktivitas TP53 dicapai melalui sistem rumit modifikasi posttranslasional, termasuk fosforilasi, asetilasi, dan ubiquitinasi, yang memengaruhi pengikatan protein TP53 ke situs tertentu dalam DNA, pergantian protein, dan interaksi dengan protein lain yang memengaruhi fungsi transkripsi protein TP53 (bahkan sebelum “aktivasi” oleh sinyal stres. Pengendalian aktivitas TP53 dicapai melalui sistem rumit modifikasi posttranslasional, termasuk fosforilasi, asetilasi, dan ubiquitinasi, yang memengaruhi pengikatan protein TP53 ke situs tertentu dalam DNA, pergantian protein, dan interaksi dengan protein lain yang memengaruhi fungsi transkripsi protein TP53 (bahkan sebelum “aktivasi” oleh sinyal stres. Pengendalian aktivitas TP53 dicapai melalui sistem rumit modifikasi posttranslasional, termasuk fosforilasi, asetilasi, dan ubiquitinasi, yang memengaruhi pengikatan protein TP53 ke situs tertentu dalam DNA, pergantian protein, dan interaksi dengan protein lain yang memengaruhi fungsi transkripsi protein TP53 (Kruse dan Gu 2009 ).
Lebih lanjut, mungkin ada peran tambahan untuk pengaturan aktivitas protein TP53 sesuai dengan level dan lokasi ekspresi gen Tp53 . Protein TP53, oleh karena itu, terletak pada konvergensi beragam proses pensinyalan yang mengkomunikasikan keadaan sel ( Gbr. 1 ). Sinyal-sinyal ini kemudian diintegrasikan untuk memperoleh respons pelindung yang dimediasi TP53; regulasi dinamis dan aktivasi fungsi protein TP53 sangat penting untuk penekanan tumor yang efektif.
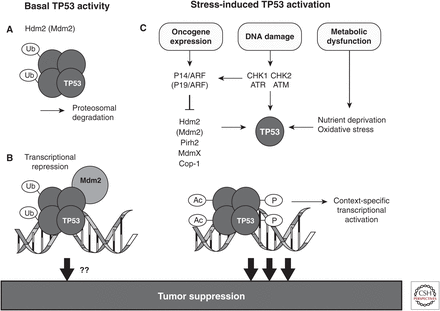
Gambar 1.
Aktivasi dan kontrol umpan balik yang tepat dari aktivitas TP53 sangat penting untuk penekanan tumor yang efektif. ( A ) Dengan tidak adanya sinyal pengaktif TP53, kadar protein TP53 dipertahankan pada level rendah di sebagian besar tipe sel oleh E3 ubiquitin ligase, MDM2 (HDM2), yang mana-mana (Ub) TP53 dan menargetkannya untuk degradasi oleh proteosom . ( B ) Protein TP53 juga dapat mengontrol ekspresi gen jika tidak ada stimulus aktif, misalnya, dengan represi transkripsi. Sejauh mana aktivitas basal TP53 berkontribusi pada fungsi penekan tumor tidak diketahui. ( C ) Stimulus stres, seperti ekspresi onkogen, kerusakan DNA, dan disfungsi metabolisme, dengan cepat menyebabkan akumulasi dan aktivasi protein TP53; ini sebagian karena penghambatan MDM2 (HDM2), sehingga mencegah ubiquitination dan degradasi proteosom TP53. Setelah aktivasi, protein TP53 bertindak sebagai faktor transkripsi spesifik-urutan yang mengarahkan ekspresi sejumlah besar gen target, yang dianggap sebagai penentu utama respons penekan tumor. Mode spesifik respon TP53 dipengaruhi oleh modifikasi posttranslasional yang luas, termasuk asetilasi (Ac) dan fosforilasi (P).
Regresi Tumor dan Regulasi Transkripsional
Setelah aktivasi, protein TP53 berfungsi terutama sebagai faktor transkripsi . Protein TP53 membentuk homotetramer yang mengikat elemen respons Tp53 spesifik dalam DNA genomik untuk mengarahkan transkripsi sejumlah besar pengkodean protein gen ( Riley et al. 2008 ). Persyaratan untuk aktivitas transkripsi TP53 dalam penekanan tumor telah diperiksa dengan secara sistematis memutasi domain transaktivasi protein TP53, menjadikannya cacat sebagian atau seluruhnya transkripsi transkripsi. Yang penting, mutasi yang mengakibatkan hilangnya sepenuhnya aktivitas transkripsi TP53 mengurangi kemampuannya untuk mencegah pembentukan tumor, mendukung konsep bahwa regulasi transkripsional merupakan pusat fungsi penekan tumor. Fungsi nontranskripsi untuk protein TP53 telah diusulkan; Namun, kepentingan biologis mereka tetap tidak pasti ( Vousden dan Lane 2007 ). Mayoritas bukti menunjukkan bahwa penindasan tumor yang dimediasi TP53 diatur oleh regulasi transkripsi; oleh karena itu, memahami target dan mekanisme gen TP53 kritis dari regulasi transkripsional mereka adalah tujuan utama.
Regulasi transkripsional yang dimediasi TP53 bervariasi sesuai dengan jenis stimulus stres dan jenis sel, sehingga proses korektif yang tepat dapat diimplementasikan. Misalnya, kerusakan DNA minor dapat menginstitusikan penangkapan siklus sel dan mengaktifkan mekanisme perbaikan DNA, sedangkan sinyal pengaktifasi TP53 yang lebih kuat menginduksi penuaan atau apoptosis. Dengan demikian, respons transkripsional TP53 bervariasi tergantung pada sifat sinyal pengaktif dan jenis sel; mekanisme terperinci yang mendasari perbedaan ini dalam induksi transkripsional gen target masih belum diketahui. Namun,Wawasan yang belum pernah terjadi sebelumnya dalam proses ini telah diperoleh melalui analisis ikatan DNA protein TP53 dan regulasi transkripsional menggunakan teknik generasi berikutnya, seperti kromatin imunopresipitasi (ChIP) DNA dan sekuensing RNA.
Jumlah gen target TP53 yang diketahui atau dicurigai telah meningkat menjadi ribuan dengan perbedaan dramatis dalam respon transkripsional yang diamati di antara jenis sel yang berbeda, rangsangan stres yang menginduksi TP53 berbeda, dan berbagai titik waktu setelah aktivasi TP53 (Jumlah gen target TP53 yang diketahui atau dicurigai telah meningkat menjadi ribuan dengan perbedaan dramatis dalam respon transkripsional yang diamati di antara jenis sel yang berbeda, rangsangan stres yang menginduksi TP53 berbeda, dan berbagai titik waktu setelah aktivasi TP53 (Jumlah gen target TP53 yang diketahui atau dicurigai telah meningkat menjadi ribuan dengan perbedaan dramatis dalam respon transkripsional yang diamati di antara jenis sel yang berbeda, rangsangan stres yang menginduksi TP53 berbeda, dan berbagai titik waktu setelah aktivasi TP53 (Allen et al. 2014 ).
Studi-studi ini melukiskan gambaran yang semakin kompleks dari mode-mode dimana TP53 dapat mengatur ekspresi gen. Misalnya, sebelum aktivasi TP53, subset gen target secara transkripsi ditekan oleh protein TP53 ( Allen et al. 2014 ). Fungsi yang lebih baru dihargai dari protein TP53 termasuk pengikatan luas dan modulasi daerah penambah di seluruh genom dan aktivasi transkripsional dari RNA nonkoding ( He et al. 2007 ; Younger et al. 2015 ). Menariknya, RNA nonkoding panjang yang diaktifkan TP53, lincRNA-p21 , memberikan penekanan luas terhadap ekspresi gen. Daftar gen target TP53 yang diusulkan sangat luas dan mereka diketahui memengaruhi beragam proses seluler, termasuk apoptosis, penangkapan siklus sel, penuaan, perbaikan kerusakan DNA, metabolisme, dan regulasi global ekspresi gen, yang masing-masing berpotensi berkontribusi pada fungsinya sebagai penekan tumor ( Gbr. 2 ).
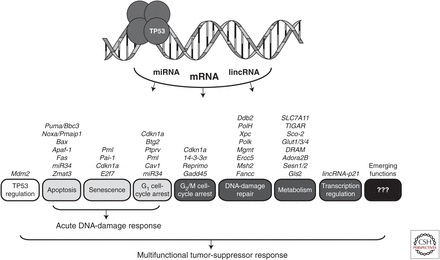
Gambar 2.
Protein TP53 menggunakan fungsi penekan tumor sebagai faktor transkripsi spesifik urutan. Setelah aktivasi, protein TP53 mengarahkan ekspresi sejumlah besar gen yang mengkode mRNA, miRNA, dan lincRNA yang mengatur berbagai proses seluler. Selain itu, TP53 mungkin memiliki fungsi efektor yang belum ditentukan yang penting untuk penekanan tumor. Semakin jelas bahwa fungsi efektor tunggal tidak memadai untuk menjelaskan potensi dan kompleksitas fungsi penekan tumor TP53. Sebaliknya,fungsi efektor spesifik mungkin lebih atau kurang penting tergantung pada konteks dan beberapa jalur efektor cenderung berkolaborasi dan bersinergi dalam pencegahan dan penindasan pembentukan tumor. Gen murine teregulasi TP53 terpilih ditunjukkan dengan proses seluler yang terkait (beberapa gen dapat berdampak pada berbagai jalur, misalnya, CDKN1a [p21], yang sangat penting untuk G1 penangkapan siklus sel dan penuaan sel).
Wawasan terhadap target transkripsional TP53 telah diperoleh dari model tikus genetik yang mengekspresikan protein TP53 mutan yang rusak secara transkripsi. Menariknya, protein TP53 cacat sebagian transaktivasi, dilambangkan TP53, hanya dapat mengaktifkan sejumlah gen target TP53 dan tidak dapat menginduksi apoptosis, penangkapan siklus-sel, atau penuaan, namun tetap kemampuan untuk menekan pembentukan tumor. Temuan pelengkap telah diamati dalam model tikus yang berbeda, di mana residu lisin utama dari protein TP53, yang dimodifikasi oleh asetilasi selama aktivasi posttranslasional, telah bermutasi menjadi arginin, dinotasikan TP53. Mirip dengan mutan TP53, protein mutan TP53 3KR tidak dapat mengaktifkan gen target yang memediasi apoptosis, penangkapan siklus-sel, dan penuaan sel, namun masih mempertahankan kemampuan untuk menekan perkembangan tumor. Pemeriksaan terhadap galur tikus mutan ini mengungkapkan regulasi yang diawetkan dari beberapa gen respons TP53 yang terlibat dalam perbaikan kerusakan DNA dan metabolisme, yang berimplikasi pada peran penting yang potensial untuk proses ini dalam penekanan tumor. Saat ini, pencarian target transkripsi penekan tumor TP53 yang kritis sedang dilakukan.
FUNGSI EFEK UTAMA UNTUK SUPPRESI TUMOR
Apoptosis
Apoptosis adalah salah satu komponen teridentifikasi paling awal dari respons penekan tumor yang dimediasi TP53 ( Yonish-Rouach et al. 1991 ). Induksi apoptosis adalah salah satu proses seluler yang dipelajari secara luas yang diaktifkan oleh protein TP53 dan telah menjadi fokus banyak penyelidikan terhadap efek penekan tumornya. Apoptosis yang terganggu adalah fitur utama dari keganasan dan perubahan genetik yang menghasilkan penghindaran dari kematian sel apoptosis yang secara nyata mempercepat perkembangan tumor.
Beberapa gen target TP53 telah terlibat dalam induksi apoptosis yang dimediasi TP53:
Puma , Noxa , Bax , Apaf1 , Fas, Tnfrsf10B / DR5 , miR34 , TP53AIP1 , Pidd , Pig3 , Zmat3 , dan Siva .
Di antara gen-gen target ini, Puma , Noxa , Bax , dan Apaf-1 memainkan peran penting dalam jalur apoptosis intrinsik (juga disebut BCL-2 atau mitokondria), sedangkan Fas dan Tnfrsf10B / DR5 mengkodekan untuk anggota keluarga tumor necrosis factor receptor (TNFR) (FAS / APO-1 / CD95 dan TRAIL-R / DR5) yang dapat memicu reseptor kematian (juga disebut jalur apoptosis ekstrinsik). Dari semua gen target TP53 ini, hanya anggota keluarga PUMA dan NOXA BH3-satunya proapoptotik yang telah divalidasi oleh penelitian-penelitian dari tikus-tikus yang ditargetkan-gen menjadi penting untuk apoptosis yang dimediasi-TP53.
Meskipun gen Bax dan Apaf-1 juga merupakan target TP53 langsung. Sel-sel yang kekurangan TP53 masih mengekspresikan efektor ini dari apoptosis. Oleh karena itu, induksi mereka kemungkinan berfungsi untuk memperkuat pensinyalan apoptosis yang dimediasi TP53. Keluarga miR34 mikroRNA adalah target TP53 ( He et al. 2007 ) diprediksi mengerahkan efek antionkogenik yang luas melalui regulasi posttranskripsi berbagai gen yang tidak hanya peka terhadap apoptosis, misalnya, dengan menurunkan regulasi BCL-2 ( Bommer et al. 2007 ), tetapi juga melalui regulasi perkembangan dan diferensiasi siklus sel. Namun, yang mengejutkan, tikus yang kekurangan semua anggota keluarga miR34 tidak rentan terhadap perkembangan tumor yang diinduksi secara spontan atau onkogen. Yang penting, jalur apoptosis reseptor kematian dapat digunakan untuk apoptosis yang diinduksi TP53. Namun, induksi yang dipediasi TP53 dari ekspresi Fas dan Tnfrsf10B / DR5 dapat berfungsi untuk membuat peka sel-sel yang stres terhadap ligan reseptor kematian, FASL dan TRAIL, dan telah diusulkan bahwa ini dapat dimanfaatkan untuk terapi kanker.
Peran apoptosis yang dimediasi TP53 dalam mencegah perkembangan kanker yang digerakkan oleh onkogen telah didefinisikan dengan menggunakan model tikus transgenik Eμ-Myc ( Adams et al. 1985 ). Di sini penambah gen rantai berat imunoglobulin (Eµ) telah disandingkan dengan c-Myc oncogene, yang menghasilkan deregulasi ekspresi c-MYC dan, akibatnya, perkembangan pesat limfoma pra-B dan sel B. Dalam model tikus Eμ-Myc , inaktivasi spontan jalur TP53, paling sering melalui mutasi pada Tp53 sendiri, terlihat pada 20% limfoma menunjukkan peran penting dalam pengaturan ini. Dengan demikian, inaktivasi fungsi TP53 secara nyata mempercepat pengembangan limfoma yang digerakkan oleh MYC. Yang mengejutkan , penghapusan lengkap gen Tp53 menggunakan CRISPR / Cas9 yang menargetkan dalam sel punca / progenitor hematopoietik Eμ-Myc (HSPC) menghasilkan perkembangan limfoma yang cepat dengan latensi rata-rata hanya 29 hari dibandingkan dengan Eμ-Myc yang tidak ditargetkanHSPC yang menimbulkan limfoma dengan latensi rata-rata> 110 d. Persyaratan spesifik untuk target transkripsi apoptosis TP53 individu dalam fungsi penekan tumor telah dibedah menggunakan model tikus Eμ-Myc di mana hilangnya BAX, PUMA, dan NOXA ( Hemann et al. 2004 ; Michalak et al. 2009 ) masing-masing dapat mempercepat pengembangan limfoma, meskipun tidak pada tingkat yang sama dengan hilangnya fungsi TP53. Ini menunjukkan peran penting untuk jalur tambahan dalam penekanan tumor selama pengembangan limfoma yang digerakkan oleh MYC.
Apoptosis jelas memainkan peran penting dalam penekanan tumor; Namun, jalur tambahan harus dinonaktifkan untuk sepenuhnya merekapitulasi efek dari hilangnya TP53. Lebih jauh lagi, studi ini menunjukkan bahwa model hewan di mana fungsi TP53 diperiksa kemungkinan akan mempengaruhi temuan eksperimental. Meskipun PUMA, NOXA, dan BAX adalah mediator penting dari apoptosis yang diinduksi TP53, mungkin ada mekanisme efektor proapoptotik tambahan yang belum sepenuhnya ditentukan. Sebagai contoh, protein BIM hanya-BH3 proapoptotik dapat diinduksi secara tidak langsung oleh TP53 dan berkontribusi pada pembunuhan sel-sel tumor oleh obat-obat kemoterapi yang dapat merusak DNA. Yang penting, ada tumpang tindih yang substansial antara regulasi kematian sel apoptosis dan jalur lain, seperti perbaikan kerusakan DNA dan metabolisme; dengan demikian, peran apoptosis dalam penekanan tumor dapat terjalin dengan efektor lain yang bergantung pada TP53.
Regulasi Siklus Sel dan Perbaikan Kerusakan DNA
Kanker adalah penyakit yang dihasilkan dari akuisisi progresif dan akumulasi mutasi genetik, dan protein TP53, sebagai “penjaga genom” ( Lane 1992 ), memiliki peran penting dalam menjaga integritas genom dan menentang. proses ini. Protein TP53 berperan penting dalam respons seluler terhadap kerusakan DNA. Sangat penting untuk respons fase akut yang melibatkan penghentian siklus sel, penuaan, dan apoptosis serta mekanisme pengawasan jangka panjang untuk mempertahankan beberapa mekanisme perbaikan kerusakan DNA, seperti perbaikan eksisi nukleotida, perbaikan eksisi dasar, dan akhir yang tidak homologis –joining.
Dalam banyak sel, respons awal yang dimediasi TP53 terhadap kerusakan DNA akut adalah induksi henti siklus sel G 1 transien , yang memungkinkan waktu untuk deteksi dan perbaikan kerusakan DNA sebelum replikasi genom dalam fase S dan pembelahan sel berikutnya. Protein TP53 juga memberikan kontrol pos pemeriksaan selama transisi G 2 / M, di mana replikasi DNA telah terjadi dan sel bersiap untuk menjalani pembelahan sel mitosis, saat kegagalan deteksi dan perbaikan DNA yang rusak mungkin paling berbahaya (misalnya, mengakibatkan aneuploidi). Kedua pos pemeriksaan siklus sel sangat penting untuk menjaga integritas genomik dan persyaratan untuk penghentian siklus sel yang dimediasi TP53 dalam menjaga stabilitas genom telah ditunjukkan secara eksperimental ( Barboza et al. 2006 ). Mediator utama dari penahanan siklus- 1 G -sel yang diinduksi TP53 dianggap CDKN1a (hal 21), seperti yang ditunjukkan oleh sel-sel dari tikus Cdkn1a - / - yang menunjukkan gangguan penangkapan siklus- 1 G 1 sebagai respons terhadap kerusakan DNA dan aktivasi TP53 ( El-Deiry et al. 1993 ; Brugarolas et al. 1995 ; Deng et al. 1995). Mengingat peran integral dari penangkapan siklus sel dalam perbaikan DNA, CDKN1a telah diusulkan untuk berkontribusi pada penekanan tumor yang dimediasi TP53. Namun, tikus yang kekurangan CDKN1a (p21) tidak rentan terhadap pembentukan tumor spontan.
Target transkripsional TP53 juga berkontribusi pada penangkapan siklus sel G 1 fase termasuk, tetapi tidak terbatas pada, gen promyelocytic ( Pml ), protein tirosin fosfatase reseptor tipe-V ( Ptprv ), Caveolin-1 ( Cav1 ) dan Btg2 . Selain itu, target TP53 lainnya khusus menghasut sel-siklus penangkapan di G 2 / M pos pemeriksaan, termasuk pertumbuhan-penangkapan dan DNA-kerusakan-inducible 45 α gen ( Gadd45α ), Reprimo , dan protein 14-3-3σ ( Taylor dan Stark 2001 ). Peran GADD45α , PTPRV , PML, dan CAV1 telah diuji secara individual melalui generasi tikus KO, tetapi tidak satu pun dari hewan ini yang secara spontan menderita kanker. Namun, mirip dengan kandidat transkrip target penekan tumor TP53 lainnya, defisiensi mereka dapat mempercepat pembentukan tumor dalam kondisi tekanan onkogenik spesifik.
Penangkapan siklus sel yang diinduksi TP53 dianggap perlu untuk memungkinkan terjadinya proses perbaikan DNA yang tepat. Lesi prakanker ditandai dengan akumulasi kerusakan DNA dan aktivasi akibat respons kerusakan-DNA yang dimediasi TP53. Akuisisi mutasi selama inisiasi tumor terjadi melalui berbagai mekanisme termasuk mutasi dan modifikasi epigenetik diikuti oleh propagasi perubahan ini karena mekanisme perbaikan kerusakan DNA yang rusak. Protein TP53 memainkan peran penting dalam semua proses ini dan, sesuai dengan pentingnya TP53 dalam menjaga stabilitas genom, sel-sel dari tikus Tp53 - / - serta kanker manusia yang cacat TP53 dicirikan oleh perubahan genomik yang tersebar luas. Sejalan dengan ini, TP53 memiliki sejumlah besar target transkripsional langsung yang memediasi jalur perbaikan DNA, termasuk Polk , Mgmt , Fancc , Ercc5 , Xpc , Ddb2 , Gadd45α , Msh2 , dan PolH . Peran sentral dari ketidakstabilan genom selama evolusi limfoma timus pada tikus Tp53 - / - telah diamati secara langsung dari waktu ke waktu, di mana perbaikan DNA yang rusak menghasilkan tingkat variasi jumlah salinan gen yang sangat tinggi, termasuk kejadian seperti kromotripsis, yang mendorong akumulasi lesi genetik bekerja sama yang diperlukan untuk transformasi maligna ( Dudgeon et al. 2014). Ini mendukung gagasan bahwa ketidakstabilan genom merupakan pendorong utama perkembangan kanker tanpa adanya protein TP53.
Pada tipe sel tertentu, aktivasi protein TP53 dapat mengakibatkan induksi apoptosis yang mengakibatkan eliminasi sel-sel yang rusak secara permanen. Namun, respon kerusakan DNA akut sebagian besar telah dikeluarkan dari peran dalam fungsi penekan tumor TP53 melalui berbagai jalur penyelidikan. Peran respon kerusakan DNA akut dalam penekanan tumor dievaluasi menggunakan restorasi protein TP53 pada waktunya pada Tp53 - / -tikus yang mengikuti iradiasi untuk menginduksi pembentukan limfoma timus. Hebatnya, restorasi TP53 sementara selama respon kerusakan DNA akut tidak menghasilkan efek penekan tumor. Sebaliknya, pemulihan fungsi TP53 sementara yang ditunda sampai setelah respons kerusakan DNA akut berakhir, pada saat tidak ada penangkapan siklus sel atau apoptosis yang dapat dilihat, cukup untuk menekan tumor. Lebih jauh, fungsi supresor tumor yang tertunda yang diamati tergantung pada p19 / ARF, yang melibatkan aktivasi TP53 yang dimediasi onkogen dalam sel-sel neoplastik yang baru lahir dalam respons ini. Ini lebih lanjut dikonfirmasi melalui studi transkripsi yang rusak dan protein asetat mutan TP53 cacat yang tidak dapat mengaktifkan respon kerusakan DNA akut namun mempertahankan fungsi penekan tumor yang kuat ( Brady et al. 2011 ; Li et al. 2012). Oleh karena itu, respons kerusakan DNA patologis akut tampaknya dapat diabaikan untuk penekanan tumor, sebuah temuan luar biasa yang juga memiliki implikasi besar untuk terapi kanker.
Konsekuensi dari ekspresi berlebih onkogen dua kali lipat dalam pengaturan kerusakan DNA dan penekanan tumor yang dimediasi TP53. Pertama, mutasi yang didapat dapat mengakibatkan aktivasi onkogen, dan sel yang mengekspresikan onkogen dapat dipilih melalui peningkatan proliferasi dan kelangsungan hidup sel. Kedua, aktivasi onkogen kronis mendorong pertumbuhan sel yang abnormal, sehingga meningkatkan risiko memperoleh lesi DNA tambahan yang dapat mengaktifkan onkogen lebih lanjut atau menonaktifkan gen penekan tumor ( Halazonetis et al. 2008). TP53 dapat bertujuan untuk menghilangkan atau menghambat pertumbuhan sel yang ditandai dengan ekspresi berlebih onkogen, yang terkait erat dengan kerusakan DNA, proliferasi sel deregulasi, dan deregulasi metabolik.
Senescence
Induksi penuaan sel pertama kali terbukti memainkan peran penting dalam penekanan tumor yang dimediasi TP53 dalam model tikus eritrolukemia ( Metz et al. 1995 ). Selain itu, pemulihan fungsi TP53 pada tumor organ padat (didorong oleh hilangnya TP53) in vivo mengarah pada induksi penuaan seluler dalam hubungannya dengan regresi tumor ( Ventura et al. 2007 ; Xue et al. 2007 ). Penuaan sel adalah keadaan sel yang berbeda yang melibatkan penangkapan siklus sel sel permanen yang tetap aktif dan aktif secara metabolik, yang ditandai dengan profil transkripsi diskrit ( Shay dan Roninson 2004). Protein TP53 mengontrol penuaan seluler dengan mengaktifkan sejumlah target transkripsi yang mencakup Cdkn1a , Pml, Pai1 , dan E2f7 , beberapa di antaranya (misalnya, Cdkn1a ) penting untuk fungsi tambahan dalam regulasi siklus sel. Senescence sering dikaitkan dengan, dan dianggap untuk menekan, lesi praligna mencegah perkembangan mereka ke keganasan terbuka. Induksi penuaan sel yang dimediasi oleh TP53 terbukti sangat penting untuk mencegah transformasi maligna pada model tikus dari adenoma paru yang digerakkan oleh BRAF ( Dankort et al. 2007 ). Selain itu, dalam sebuah penelitian yang meneliti interdependensi fungsional cacat pada PTEN dan TP53 dalam pengembangan karsinoma prostat, penuaan yang dimediasi TP53 diperlukan untuk mencegah perkembangan kanker dalam pengaturan penghapusan PTEN. Masih harus diperiksa apakah hilangnya seluruh gen target yang terlibat dalam penuaan bermediasi TP53 dapat merekapitulasi perkembangan tumor spontan yang terlihat pada Tp53 - / - tikus dan apakah hubungan kuat antara penuaan dan penekanan tumor adalah kausal atau apakah ini merupakan hubungan dengan efek yang dimediasi TP53 lainnya.
Metabolisme
Proliferasi sel yang cepat, pertumbuhan anabolik, dan stres metabolik yang melambangkan penyakit neoplastik membutuhkan pemrograman ulang metabolik yang substansial. Selain itu, deregulasi metabolik tidak hanya berdampak pada produksi energi dan pertumbuhan sel tetapi juga mempengaruhi proses tambahan yang penting untuk pertumbuhan kanker yang berkelanjutan, seperti biosintesis makromolekul, regulasi epigenetik, dan jalur antioksidan ( Cairns et al. 2011 ; Ward dan Thompson 2012 ). Protein TP53 adalah pengatur penting metabolisme seluler dan banyak dari proses yang disebutkan sebelumnya dipengaruhi oleh stres metabolik.
Deskripsi karakteristik terbaik dari pemrograman ulang metabolik terkait kanker adalah efek Warburg, di mana glukosa sebagian besar dimetabolisme oleh glikolisis daripada fosforilasi oksidatif, seperti yang biasanya terjadi dalam kondisi aerob ( Warburg 1956 ). Aktivasi TP53 merangsang fosforilasi oksidatif dan menghambat glikolisis, yang keduanya menentang efek Warburg. Protein TP53 dapat mengatur ekspresi beberapa transporter glukosa, termasuk GLUT1, GLUT3, dan GLUT4 yang mengurangi glikolisis melalui gangguan pengambilan glukosa. TP53 juga mentransaktivasi gen glikolisis dan apoptosis regulator ( TIGAR ) yang diinduksi TP53 , yang mengkode enzim fruktosa fosfatase yang menghambat glikolisis dan meningkatkan produksi NADPH. NADPH penting untuk pembersihan spesies oksigen reaktif (ROS), dan efek antioksidan TIGAR ini menganugerahkan fungsi prosurvival dalam pengaturan kematian sel yang dimediasi ROS. Namun, tikus KO TIGAR tidak menunjukkan pembentukan tumor spontan dan, dalam beberapa konteks, defisiensi TIGAR sebenarnya menghambat perkembangan tumor. TP53 juga secara langsung merangsang fosforilasi oksidatif mitokondria melalui aktivasi transkripsi dari sintesis gen-sitokrom c oksidase 2 ( Sco2 ). Menariknya, fosforilasi oksidatif yang tidak teratur telah diamati dalam sel dari pasien dengan sindrom Li-Fraumeni, yang sebagian disebabkan oleh ekspresi Sco-2 yang berubah ( Wang et al. 2013 ).
Regulasi ketat mekanisme antioksidan seluler sangat penting untuk mempertahankan jalur pensinyalan intraseluler dan menghindari toksisitas terkait ROS. Oleh karena itu, disregulasi proses ini dapat berkontribusi pada perkembangan kanker ( Finkel 2003 ). Gen yang mengkode enzim dengan fungsi antioksidan, termasuk Gls2 , Sestrin 1 , dan Sestrin 2 , telah diidentifikasi sebagai target transkripsional TP53, yang mendefinisikan mekanisme dimana TP53 dapat mengatur pensinyalan pensinyalan dan pengelolaan oksidan stres oksidatif. Menariknya, pengobatan Tp53 tikus knockout dengan terapi antioksidan dilaporkan menunda timbulnya pembentukan tumor, berimplikasi peran untuk membatasi akumulasi ROS dalam penekanan tumor yang dimediasi TP53 ( Sablina et al. 2005 ).
Stres metabolik dan hipoksia terkait kanker dapat mengaktifkan jalur kematian sel yang berbeda melalui berbagai mekanisme, termasuk jalur apoptosis intrinsik. TP53 dapat memodulasi kematian metabolik yang diinduksi stres oleh stres melalui sejumlah mekanisme. Sebagai contoh, protein TP53 mendorong ekspresi gen ADORA2B , yang dapat mendeteksi ketersediaan nutrisi dan membuat sel peka terhadap kematian sel apoptosis yang dimediasi oleh PUMA ( Long et al. 2013 ). Selain itu, bentuk kematian sel nonapoptosis yang bergantung pada zat besi yang baru-baru ini dijelaskan, dilambangkan dengan ferroptosis, dimulai pada kondisi stres metabolik dan akumulasi ROS ( Dixon et al. 2012). Telah diusulkan bahwa TP53 memediasi penindasan tumor melalui represi transkripsional gen SLC7A11 , yang mengkode antiporter sistin / glutamat yang mengurangi kecenderungan seluler untuk ferroptosis ( Jiang et al. 2015 ).
Akhirnya, autophagy adalah proses metabolisme lain yang diatur TP53 yang dapat berkontribusi pada penekanan tumor ( Maiuri dkk. 2010 ; Kenzelmann Broz dkk. 2013 ). Autophagy memungkinkan sel untuk beradaptasi dan bertahan dalam kondisi membatasi ketersediaan nutrisi dengan mendaur ulang konten intraseluler, seperti protein dan organel yang rusak untuk tujuan membebaskan energi dan metabolit untuk mempertahankan integritas seluler. Autophagy lebih lanjut dapat berdampak pada penekanan tumor dengan mempengaruhi jalur apoptosis dan stabilitas genom. TP53 mengatur autophagy pada berbagai tingkatan dengan mentransaktivasi sejumlah besar gen, termasuk gen yang mengkode kerusakan mediator autofag terkait (DRAM) dan ULK1. Menariknya, knockdown yang dimediasi siRNA dari DRAM terbukti mengurangi apoptosis yang bergantung pada TP53 ( Crighton et al. 2006 ).
FUNGSI TP53 YANG MUNCUL DAN SUPPRESI TUMOR
Komponen baru dari respons TP53 terus muncul dan banyak dari ini telah terlibat dalam penekanan tumor ( Bieging et al. 2014 ; Hager dan Gu 2014 ). Ini termasuk peran untuk TP53 dalam fungsi sel induk, diferensiasi, invasi seluler, dan metastasis, serta regulasi respon imun dan lingkungan mikro tumor. Sebagai contoh, dalam model tikus dari karsinoma hepatoseluler, TP53 terbukti mempengaruhi lingkungan mikro dan respon imun melalui mekanisme otonom sel-tumor, yang berdampak pada laju ekspansi dan agresivitas tumor ( Lujambio et al. 2013)). Fungsi-fungsi yang muncul ini memiliki peran yang belum ditentukan dalam penekanan tumor; Namun, mereka menyoroti gambaran yang semakin kompleks tentang peran TP53 dalam biologi kanker.
Selain fungsi yang baru diidentifikasi untuk protein TP53, pendekatan baru untuk memahami mekanisme penekanan tumor sedang muncul. Persaingan sel baru-baru ini telah ditetapkan sebagai mekanisme bonafid untuk penekanan tumor ( Martins et al. 2014 ) ketika ditunjukkan bahwa gangguan kompetisi sel normal dalam timus mengarah pada pembentukan leukemia T-limfoblastik akut. Konsep kompetisi sel memberikan pandangan tentang kesesuaian sel secara keseluruhan karena mereka bersaing dalam populasi sel yang lebih besar, yang memperhitungkan berbagai atribut seluler serta faktor yang tergantung pada konteks. Dalam studi sel progenitor hematopoietik, protein TP53 terbukti memediasi kompetisi sel (Bondar dan Medzhitov 2010 ), meningkatkan kemungkinan bahwa persaingan sel mungkin merupakan kerangka kerja yang penting untuk mendekati masalah penekanan tumor yang dimediasi TP53.
Bagian sebelumnyaBagian selanjutnya
DISTINCTIONS ANTARA KANKER MANUSIA DAN MODEL MOUSE
Penting untuk mengenali sejumlah perbedaan utama antara temuan dari model tikus dan penyakit manusia. Pada kanker manusia, inaktivasi gen TP53 hampir selalu terjadi dengan perolehan mutasi missense daripada penghapusan gen TP53 . Lebih jauh, mutasi ini sering menghasilkan substitusi asam amino tunggal dan produksi protein TP53 yang stabil dan diekspresikan secara aktif yang dapat berkontribusi pada perkembangan dan pertumbuhan tumor melebihi konsekuensi kehilangan fungsi TP53 tipe liar saja ( Freed-Pastor dan Prives) 2012 ). Selain itu, akuisisi awal Tp53 mutasi biasanya diikuti oleh hilangnya heterozigositas, yang biasanya melibatkan penghapusan besar lengan pendek kromosom 17 (17p). Penghapusan kromosom yang besar mengakibatkan hilangnya beberapa gen tambahan dan ini meningkatkan kemungkinan bahwa lesi yang bekerja bersama pada 17p dapat berkontribusi pada kanker manusia. Misalnya, gen yang mengkode komponen kompleks RNA polimerase II, POLR2A , hampir selalu dikodekan pada kanker manusia dengan gen TP53 , dan ini memiliki dampak fungsional pada tumor yang dihasilkan ( Liu et al. 2015 ). Ini adalah fitur penting dari kanker manusia yang tidak dapat dipisahkan dari pertanyaan untuk memahami bagaimana kehilangan atau mutasi TP53 mengarah pada perkembangan kanker.
SIMPULAN PENUTUP
Fungsi penekan tumor dari protein TP53 cenderung dimediasi melalui sejumlah fungsi efektor yang berkolaborasi daripada melalui jalur tunggal atau target transkripsi tunggal. Memahami bagaimana mekanisme ini bekerja bersama akan memerlukan pendekatan kreatif untuk investigasi yang mempertimbangkan sifat kombinasi dan kompleksitas respon TP53 serta pertimbangan fungsinya dalam proses seluler normal. Ini adalah pertanyaan yang menarik tentang apakah tujuan utama protein TP53 adalah penekanan tumor atau apakah ini merupakan manifestasi sekunder dari banyak peran penting dalam biologi normal. Sebagai contoh,pentingnya protein TP53 dalam menjaga stabilitas genom melampaui pencegahan kanker menjadi persyaratan dasar untuk kehidupan yang berkelanjutan yang memastikan bahan genetik organisme ditransmisikan dengan setia kepada generasi berikutnya (Jackson dan Bartek 2009 ; Kerr et al. 2012 ) dan berbicara tentang konservasi evolusi keluarga gen Tp53 dari organisme multisel paling awal hingga manusia ( Belyi et al. 2010 ; Lane et al. 2010 ). Pertimbangan penting lainnya adalah bahwa TP53 berkontribusi pada proses seluler normal yang mungkin juga penting pada tumor yang sudah mapan. Sebagai contoh, TP53 memfasilitasi adaptasi terhadap beberapa bentuk stres metabolik, seperti kekurangan serin, di mana sel Tp53 - / - sebenarnya dirugikan ( Maddocks et al. 2013). Dengan demikian, hilangnya fungsi TP53 selama inisiasi kanker mungkin tidak sepenuhnya menguntungkan dan kerentanan tersebut dapat dieksploitasi untuk pengobatan kanker yang kekurangan TP53. Memahami peran TP53 dalam penekanan tumor tetap menjadi salah satu pertanyaan biologis paling menarik dan penting yang menjanjikan kemajuan menarik untuk 30 tahun penelitian TP53 berikutnya.
