𝙍𝙚𝙖𝙠𝙨𝙞 𝙤𝙠𝙨𝙞𝙙𝙖𝙨𝙞 𝙙𝙖𝙣 𝙧𝙚𝙙𝙪𝙠𝙨𝙞 𝙗𝙚𝙧𝙖𝙧𝙩𝙞 𝙢𝙚𝙣𝙙𝙖𝙥𝙖𝙩𝙠𝙖𝙣 𝙙𝙖𝙣 𝙢𝙚𝙡𝙚𝙥𝙖𝙨𝙠𝙖𝙣 𝙤𝙠𝙨𝙞𝙜𝙚𝙣, 𝙖𝙩𝙖𝙪 𝙩𝙧𝙖𝙣𝙨𝙛𝙚𝙧 𝙚𝙡𝙚𝙠𝙩𝙧𝙤𝙣 𝙖𝙣𝙩𝙖𝙧𝙯𝙖𝙩 𝙙𝙖𝙡𝙖𝙢 𝙨𝙪𝙖𝙩𝙪 𝙧𝙚𝙖𝙠𝙨𝙞 𝙠𝙞𝙢𝙞𝙖.
𝖮ksigen adalah unsur umum dan reaktif yang bergabung dengan kebanyakan unsur lain. Sebagai contoh, memanaskan tembaga di udara Akan membentuk lapisan permukaan berupa oksida tembaga hitam. Contoh lain adalah gas hidrogen terbakar di udara dan membentuk air. Hasil dari kedua reaksi tersebut adalah oksida. Karena itu, kimiawan menggolongkan dua jenis reaksi itu sebagai oksidasi.
𝘙𝘌𝘈𝘒𝘚𝘐 𝘙𝘌𝘋𝘖𝘒𝘚
Ketika gas hidrogen melewati oksida tembaga panas, hidrogen mengambil oksigen dari oksida tembaga untuk membentuk logam tembaga dan air. Persamaan untuk reaksi antara tembaga oksida dan hidrogen ini menunjukkan apa yang terjadi:
CuO + H2 -> Cu + H2O
Hidrogen bergabung dengan oksigen dari tembaga oksida untuk membentuk air. Maka dalam reaksi ini hidrogen teroksidasi. Pada saat yang sama, tembaga oksida tereduksi menjadi logam tembaga dengan mengeluarkan oksigennya.
Reaksi jenis ini disebut reaksi redoks, karena mereka merupakan kombinasi Reaksi reduksi dan oksidasi. Zat yang menyebabkan oksidasi - dalam hal ini tembaga oksida - disebut oksidan. Reduktan adalah zat yang menyebabkan reduksi. Dalam reaksi ini, yang menjadi reduktan adalah hidrogen.
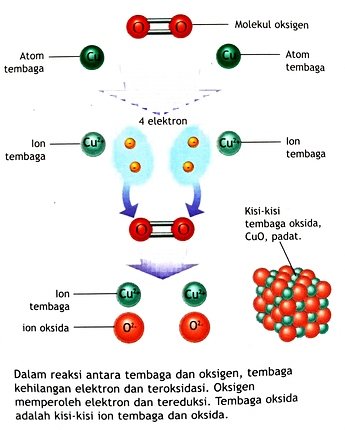
𝘛𝘙𝘈𝘕𝘚𝘍𝘌𝘙 𝘌𝘓𝘌𝘒𝘛𝘙𝘖𝘕
Para kimiawan menerangkan reaksi redoks dalam hal transfer elektron antar zat. Reaksi antara tembaga dan oksigen membentuk tembaga oksida, CuO , yang mengandung ion tembaga, Cu2+ , dan ion oksida, O2 - .
Dalam reaksi tersebut, Setiap atom tembaga kehilangan 2 elektron ketika atom tersebut menjadi ion tembaga.
Elektron-elektron ini diterima oleh molekul oksigen, yang masing-masing membentuk ion oksida. Secara umum, oksidasi adalah pelepasan elektron dari suatu zat. Sedangkan reduksi adalah penambahan elektron pada suatu zat.
Bila reaksi redoks dijelaskan sebagai transfer elektron, banyak reaksi yang tidak melibatkan Oksigen dapat digolongkan sebagai reaksi oksidasi dan reduksi. Sebagai contoh, reaksi antara logam natrium dan klorin suatu reaksi redoks. Setiap atom natrium, Na, kehilangan satu elektron untuk membentuk satu ion natrium, Na+ . Pada saat yang sama, setiap molekul klorin, Cl2, mendapat 2 elektron untuk membentuk 2 ion klorida. Hasilnya adalah senyawa ionik natrium klorida, NaCl. Dalam reaksi ini Klorin adalah oksidannya. Sementara yang menjadi reduktan adalah natrium.
𝘙𝘦𝘧𝘦𝘳𝘦𝘯𝘴𝘪:
𝘉𝘜𝘒𝘜 𝘌𝘕𝘚𝘐𝘒𝘓𝘖𝘗𝘌𝘋𝘐𝘈 𝘐𝘗𝘛𝘌𝘒
𝘌𝘕𝘚𝘐𝘒𝘓𝘖𝘗𝘌𝘋𝘐𝘈 𝘚𝘈𝘐𝘕𝘚 𝘜𝘕𝘛𝘜𝘒 𝘗𝘌𝘓𝘈𝘑𝘈𝘙 𝘋𝘈𝘕 𝘜𝘔𝘜𝘔
𝘒𝘐𝘔𝘐𝘈 𝘋𝘈𝘕 𝘜𝘕𝘚𝘜𝘙 - 𝘉𝘈𝘏𝘈𝘕 𝘋𝘈𝘕 𝘛𝘌𝘒𝘕𝘖𝘓𝘖𝘎𝘐
𝗧𝗨𝗚𝗔𝗦 𝗞𝗘𝗟𝗢𝗠𝗣𝗢𝗞 19 𝗗𝗠𝗖