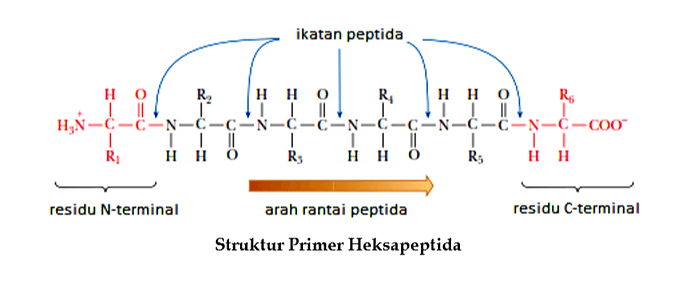
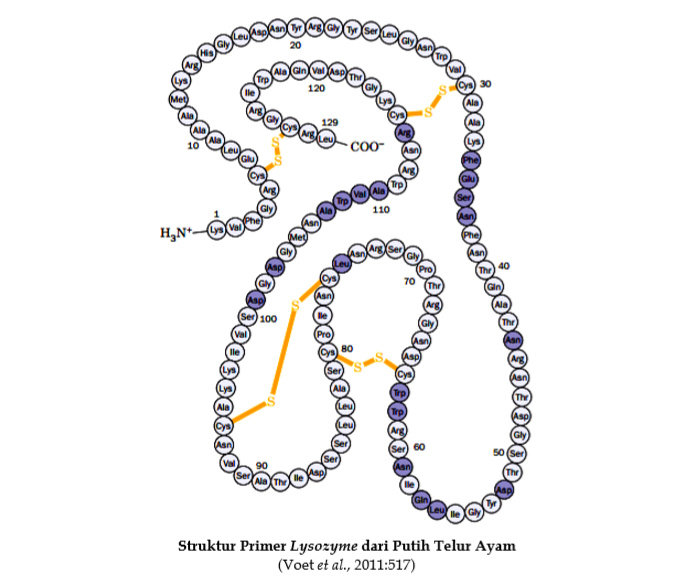
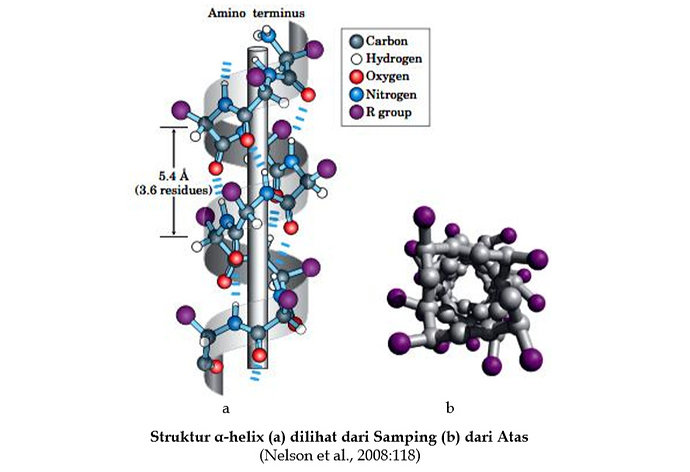
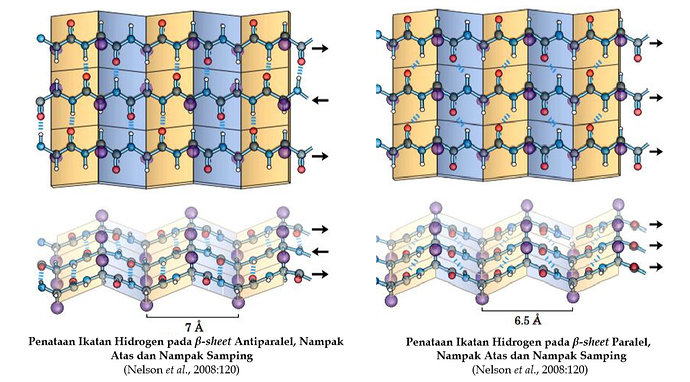
Struktur Tersier Protein
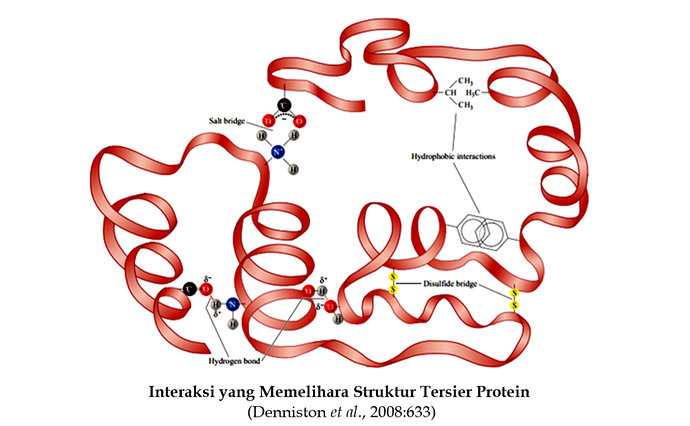
Struktur sekunder protein merupakan penataan ruang dari residu asam amino yang berdekatan di dalam segmen suatu polipeptida. Interaksi antara segmen tersebut pada rantai polipeptida menghasilkan struktur tersier protein. Dengan kata lain, struktur tersier protein berkaitan dengan pelipatan selanjutnya dari struktur sekunder. Apakah kedua ujung (ujung-N dan ujung-C polipeptida) akan mendekat atau menjauh? Interaksi apakah yang dilibatkan pada struktur tersier protein? Interaksi non kovalen antara rantai samping residu asam amino dan ikatan kovalen disulfida memainkan peranan yang menentukan struktur tersier protein. Interaksi non kovalen termasuk ikatan hidrogen, ikatan ionik dan gaya van der Waals. Dengan demikian, penataan keseluruhan struktur tiga-dimensi dari semua atom-atom di dalam suatu protein direfer sebagai struktur tersier protein. Interaksi yang memelihara struktur tersier protein seperti pada gambar di bawah. Interaksi ini sangat dipengaruhi oleh perubahan pH dan suhu.
Teknik eksperimen yang digunakan untuk menentukan struktur tersier protein adalah kristalografi sinar-X (X-ray crystallography). Kristal sempurna dari beberapa protein dapat ditumbuhkan dengan hati-hati pada kondisi yang dikontrol. Pada kristal demikian semua molekul protein mempunyai konformasi tiga-dimensi yang sama dan mempunyai orientasi yang sama. Kristal dengan kualitas seperti ini dapat terbentuk dari protein dengan kemurnian yang sangat tinggi. Dengan demikian, tidak akan diperoleh struktur protein jika protein tidak dapat dikristalkan. Mengkristalkan protein untuk menentukan struktur tersiernya merupakan areal riset yang berkembang saat ini. Struktur tersier suatu protein misalnya exoinulinase, endoinulinase telah ditemukan dan dapat dilihat pada basis data Protein Data Bank (PDB).
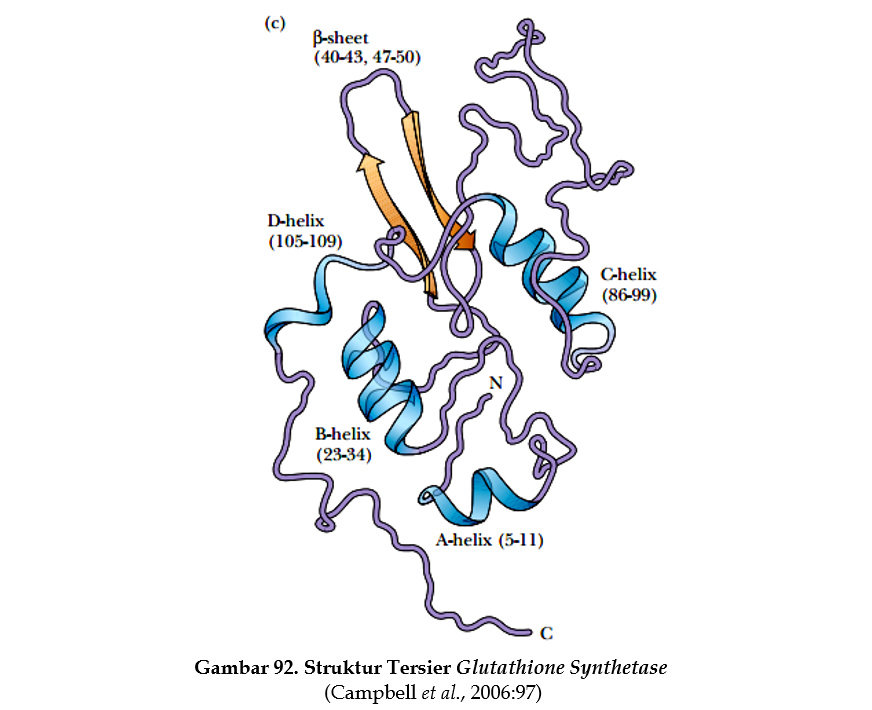
Struktur tersier glutathione synthetase diperoleh dengan teknik kristalografi sinar-X. Pada struktur tersier glutathione synthetase terdapat 4 buah daerah helix yaitu A-helix (residu asam amino 5-11), B-helix (23-34), C-helix (86-99), D-helix (105-109). Daerah β-sheet (4043, 47-50). Daerah yang berbelok dan berpilin tidak beraturan adalah daerah loop dan turn.
Gambar di atas merupakan struktur tersier glutathione synthetase yang merupakan tafsiran dari data kristalografi sinar-X. Dengan demikian, pada struktur tersier suatu protein kita dapat melihat struktur sekunder dan struktur primernya. Jika struktur primer rusak, maka struktur sekunder dan tersier akan rusak. Namun jika struktur sekunder dan tersier rusak, belum tentu merusak struktur primer. Untuk mengerti struktur tiga dimensi suatu protein kita perlu menganalisa pola pelipatannya. Kami mulai dengan pendefinisian dua istilah penting yang menggambarkan pola struktur protein atau pola struktur bagian dari sebuah rantai protein yaitu motif dan domain.
Motif
Motif disebut juga struktur supersekunder. Motif adalah kombinasi dari α-helix, β-sheet dan loop yang terdapat pada sejumlah protein yang berbeda. Kadang-kadang motif berhubungan dengan fungsi khusus. Meskipun suatu motif secara struktural mirip mungkin mempunyai fungsi yang berbeda pada protein yang berbeda. Satu motif yang paling sederhana adalah helix-loop-helix. Struktur ini terjadi pada sejumlah protein yang mengikat Calsium. Residu Glutamat dan Aspartat pada loop dari protein ini membentuk bagian sisi pengikatan Calsium. Versi protein mengikat DNA dari struktur supersekunder dinamakan motif helix-turn-helix karena residu yang menghubungkan bentuk helix membentuk putar balik. Pada protein ini, residu dari α-helix mengikat DNA.
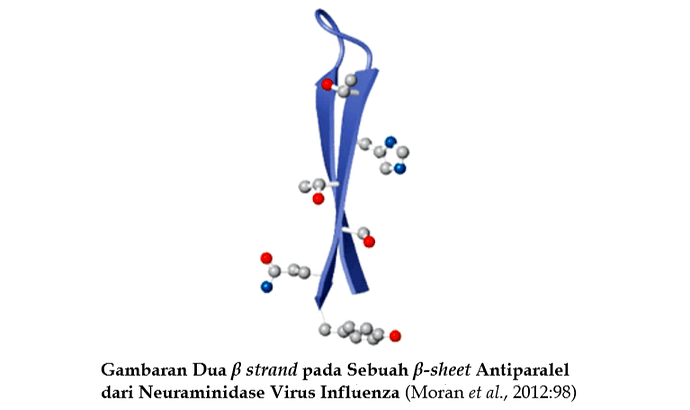
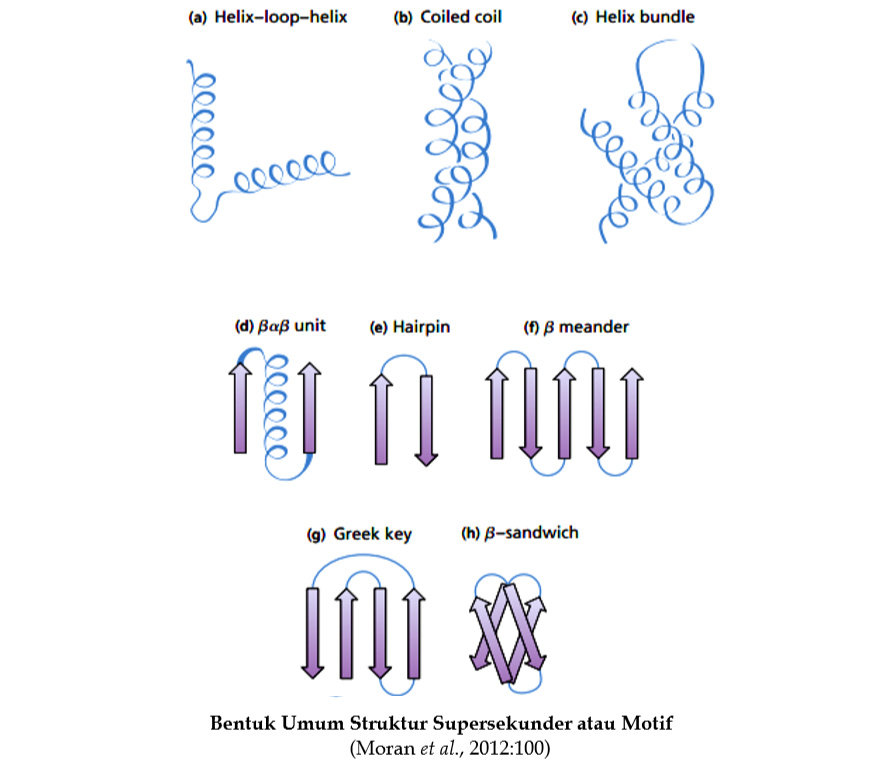
Beberapa bentuk umum struktur supersekunder atau motif adalah helix-loop-helix, coiled, helix bundle, βαβ unit, hairpain, β meander, Greek key, β-sandwich (Gambar 93). Panah menunjukkan arah β strand ujung-N ke ujung-C dari rantai pebtida. Motif coiledcoil terdiri dari dua amphipathic α-helix yang berinteraksi melalui tepi hidrophobik. Beberapa α-helix dapat berasosiasi untuk membentuk sebuah bundelan helix. Pada kasus ini α-helix individual mempunyai orientasi berlawanan dimana α-helix adalah paralel pada motif coiled-coil. Motif βαβ terdiri dari dua β strand paralel yang diantaranya terdapat sebuah α-helix yang dihubungkan oleh dua loop. helix menghubungkan ujung terminal-C dari sebuah β strand ke ujung terminal-N berikutnya dan sering paralel ke dua untai. Hairpin terdiri dari dua β strand antiparalel yang berdekatan yang dihubungkan oleh sebuah β turn.
Motif β meander merupakan sebuah β-sheet antiparalel yang tersusun oleh sederetan β strand yang dihubungkan oleh loop atau turn. β meander sheet mungkin mengandung satu atau lebih hairpin tetapi biasanya β strand dihubungkan oleh loop yang lebih besar. Nama motif Greek key berasal dari desain yang ditemukan pada keramik klasik Yunani. Motif ini adalah sebuah motif β-sheet yang menghubungkan empat β strand antiparalel dimana strand 3 dan 4 di tepi dari sheet, sedangkan 1 dan 2 terletak di tengah dari sheet. Motif β sandwich dibentuk ketika β strand atau sheet bertumpukan di atas satu sama lainnya. Pada Gambar 93 diperlihatkan contoh β sandwich dimana β strand dihubungkan oleh loop yang pendek dan turn tetapi β sandwich dapat juga dibentuk oleh interaksi dari dua β-sheet pada daerah yang berbeda dari rantai polipeptida.
Domain
Istilah kedua untuk menggambarkan pola struktural adalah domain. Sebuah domain didefinisikan sebagai bagian dari sebuah rantai polipeptida yang stabil secara bebas atau dapat mengalami pergerakan sebagai sebuah kesatuan tunggal dengan respect ke seluruhan protein. Pada domain terdapat pelipatan yang terpisah secara bebas. Polipeptida dengan lebih dari pada ratusan residu asam amino sering melipat membentuk dua atau lebih domain yang kadang-kadang dengan fungsi yang berbeda. Protein kecil biasanya mempunyai hanya satu domain.
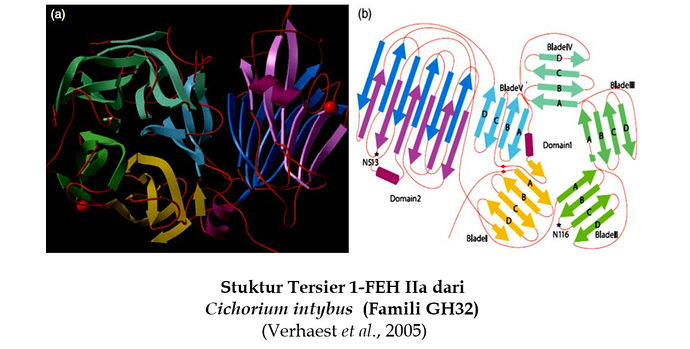
Setiap domain merupakan unit kompak yang berbeda yang terdiri dari bermacam struktur sekunder. Domain biasanya dihubungkan oleh loop, tetapi domain juga diikat satu sama lain melalui interaksi yang lemah yang dibentuk oleh rantai samping residu asam amino pada permukaan setiap domain. Kebanyakan protein disusun dari beberapa domain berlainan yang kompak. Domain mungkin terdiri dari kombinasi dari beberapa motif. Ukuran sebuah domain bervariasi dari sedikitnya 25 sampai 30 residu asam amino bahkan lebih dari 300. Sebagai contoh adalah stuktur tersier fructan 1-exohydrolase IIa (1-FEH IIa) dari Cichorium intybus (Verhaest et al., 2005).
Secara keseluruhan struktur tersier 1-FEH IIa melipat membentuk dua domain, yaitu β-propeller pada domain N-terminal (Domain 1) dan β-sandwich pada domain C-terminal (Domain 2). Domain β-propeller membentuk lima lipatan β-proppeller berulang seperti selinder yaitu blade I sampai blade V. Masing-masing blade pada 1-FEH IIa membentuk empat β-strand antiparalel yang ditandai dengan huruf A, B, C dan D dari arah dalam ke luar propeller. Aktivitas katalitik terletak pada domain β-propeller. Domain β-sandwich terbentuk dari dua β-sheet yang setiap β-sheet terdiri dari enam β-strand antiparalel. Struktur tersier 1-FEH IIa dari Cichorium intybus dimuat pada berikut.
Domain β-propeller dan β-sandwich dihubungkan oleh polipeptida pendek dengan posisi dan orientasi relatif dari domain. Domain distabilkan oleh ikatan hidrogen dan interaksi hidrofobik. Pelipatan β-sandwich merupakan modul pengikat karbohidrat (Carbohydrate-Binding Module, CBM) yang termasuk ke dalam 14 keluarga CBM yaitu CBM2,CBM3, CBM4, CBM6, CBM9, CBM15, CBM17, CBM22, CBM27, CBM28, CBM29, CBM32, CBM34 dan CBM36 (Boraston et al., 2004). Secara umum, fungsi CBM adalah mempromosikan hubungan enzim dengan substrat (Boraston et al., 2004). Fungsi β-sandwich mungkin terlibat dalam pengikatan fruktan (Verhaest et al., 2005).
Setiap domain merupakan unit kompak berbeda yang terdiri dari bermacam struktur sekunder. Domain biasanya dihubungkan oleh loop tetapi domain juga diikat satu sama lain melalui interaksi yang lemah yang dibentuk oleh rantai samping residu asam amino pada permukaan setiap domain. Pada umumnya, protein dapat dikelompokkan ke dalam famili menurut kemiripan struktur domain dan sekuens asam aminonya. Enzim-enzim yang mengkatalisis reaksi hidrolisis ikatan glikosida pada karbohidrat dinamakan glikosida hidrolase (GH) dengan kode EC 3.2.1.X. Nama lain glikosida hidrolase adalah glikosidase atau O-glycosyl hydrolase. Enzim-enzim glikosida hidrolase dikelompokkan dalam keluarga (family) berdasarkan kemiripan urutan residu asam aminonya. Pada situs Carbohydrate Active enZyme (CAZy) terdapat 131 keluarga GH (CAZy - GH, pada 13 Januari 2013). Fructan 1-exohydrolase IIa (1-FEH IIa) dari Cichorium intybus termasuk GH32.