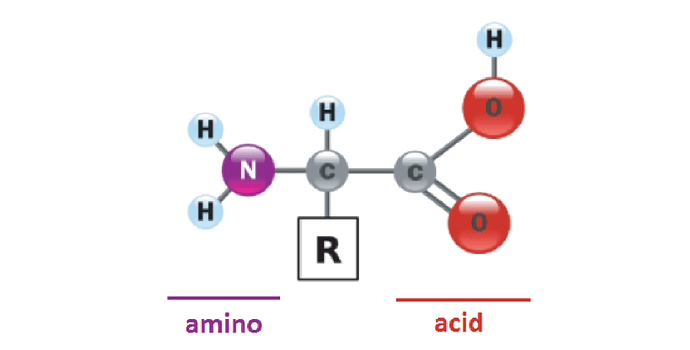
Protein adalah polimer dari asam amino. Semua organisme menggunakan 20 asam amino yang sama sebagai unit pembangun suatu molekul protein. Kedua puluh asam amino ini adalah asam amino normal yang terdapat pada protein alami. Asam amino pertama yang ditemukan adalah asparagin pada tahun 1806, sedangkan asam amino yang terakhir ditemukan adalah treonin yang belum teridentifikasi sampai tahun 1938. Protein alami terdiri dari kombinasi keduapuluh asam amino. Kedua puluh asam amino ini adalah α-amino acid. Sembilan belas dari dua puluh asam amino yang umumnya diisolasi dari protein alami mempunyai struktur umum yang sama dengan amina primer pada α-karbon. Asam amino lainnya adalah prolin yang merupakan amina sekunder.
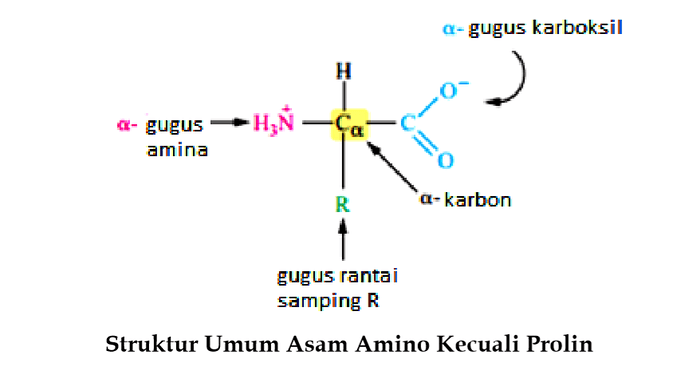
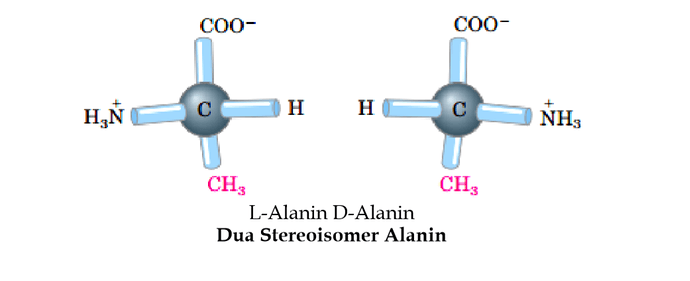
Semua asam amino kecuali glisin, pada α-karbon terikat empat gugus yang berbeda yaitu gugus karboksilat (gugus karboksil yang kehilangan sebuah proton, -COO-) dan gugus amino terprotonasi (gugus amino yang memperoleh sebuah proton, NH3+), gugus rantai samping ® dan atom hidrogen. Atom αkarbon demikian dinamakan kiral. Penataan gugus yang terikat pada α-karbon adalah tetrahendral. Empat gugus ini dapat melingkupi dua penataan ruang terpisah yang unik yaitu stereoisomer L dan D. Hampir semua asam α-amino yang diisolasi dari protein alami mempunyai stereoisomer L.
Pada pH 7, kondisi yang diperlukan untuk fungsi hidup, kita tidak akan menemukan asam amino yang gugus karboksilatnya diprotonasi (-COOH) dan gugus aminonya tidak terprotonasi (NH2). Pada kondisi ini, gugus karboksil membentuk basa konjugate (-COO-) dan gugus amina membentuk asam konjugate (-NH3+). Molekul netral dengan jumlah muatan positip dan negatif sama dinamakan zwitterion. Dengan demikian, asam amino dalam air berada sebagai ion dipolar yang dinamakan zwitterion.
Pada α-karbon setiap asam amino juga terikat atom hidrogen dan sebuah rantai samping, atau gugus R. Pada protein, gugus R berinteraksi dengan R lainnya melalui interaksi yang lemah yang bervariasi. Interaksi ini perpartisipasi dalam pelipatan rantai protein membentuk struktur tiga dimensi yang menentukan fungsinya.
Dengan karkteristik demikian, bagaimana asam amino dikelompokkan?
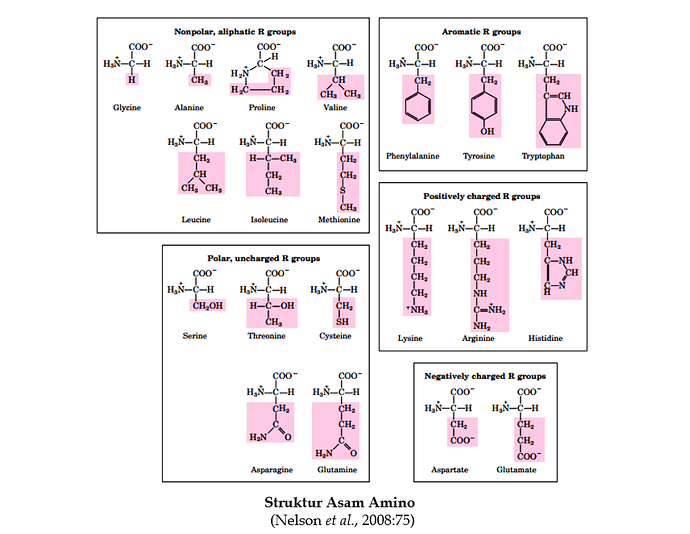
Semua asam amino mempunyai sebuah gugus karboksil dan sebuah gugus amina. Perbedaan asam amino terletak pada rantai samping (gugus R). Rantai samping asam amino bervariasi dalam hal struktur, ukuran, muatan listrik dan kelarutannya di dalam air. Asam amino dapat dikelompokkan menurut kepolaran rantai sampingnya. Rantai samping beberapa asam amino adalah nonpolar. Asam amino tersebut lebih menyukai kontak dengan rantai samping asam amino nonpolar daripada kontak dengan air dan dikatakan asam amino hydrophobic (water-fearing). Oleh sebab itu, residu asam amino ini ditemukan pada interior protein globular. Asam amino ini dapat berasosiasi dengan yang lainnya dan tetap terpisah dari air. Sembilan asam amino masuk kategori ini yaitu alanin, valin, leusin, isolusin, prolin, glisin, metionin, phenilalanin dan triptopan. Gugus R pada prolin adalah unik. Gugus ini berikatan dengan gugus αamino membentuk amina sekunder.
Sebelas asam amino mempunyai rantai samping polar karena rantai samping asam amino ini berinteraksi dengan molekul air dan dikatakan asam amino hidrophilic (water-loving). Asam amino hidrophilic disebut juga asam amino polar. Rantai samping residu asam amino ini sering ditemukan pada permukaan protein globular. Asam amino polar dikelompokkan menjadi tiga yaitu:
-
Asam amino netral tetapi polar
Asam amino ini mempunyai gugus R affinitas tinggi pada air tetapi tidak ionik pada pH 7. Serin, treonin, tirosin, sistein, asparagin dan glutamin masuk ke dalam kategori ini. Kebanyakan asam amino ini berasosiasi dengan yang lainnya melalui ikatan hidrogen, tetapi sistein membentuk ikatan disulfida dengan sistein lainnya.
-
Asam amino bermuatan negatif
Asam amino ini mempunyai gugus karboksil terionisasi pada rantai sampingnya. Pada pH 7, asam amino ini bermuatan total -1. Aspartat dan glutamat adalah dua asam amino masuk ke dalam kategori ini. Asam amino ini adalah asam amino bersifat asam karena ionisasi dari asam karboksilat melepaskan proton.
-
Asam amino bermuatan positip
Pada pH 7, lisin, arginin dan histidin mempunyai muatan total negatif karena rantai sampingnya mengandung gugus positip. Asam amino ini bersifat basa karena rantai samping dengan air mengambil proton dan melepaskan anion hidroksida.
Asam aminopun dapat dikelompokkan berdasarkan gugus rantai sampingnya yaitu:
-
Tujuh asam amino mempunyai gugus R aliphatik nonpolar
-
Tiga asam amino mempunyai gugus R aromatik
-
Lima asam amino mempunyai gugus R tidak bermuatan, polar
-
Tiga asam amino mempunyai gugus R bermuatan positip 5. Dua asam amino mempunyai gugus R bermuatan negatif