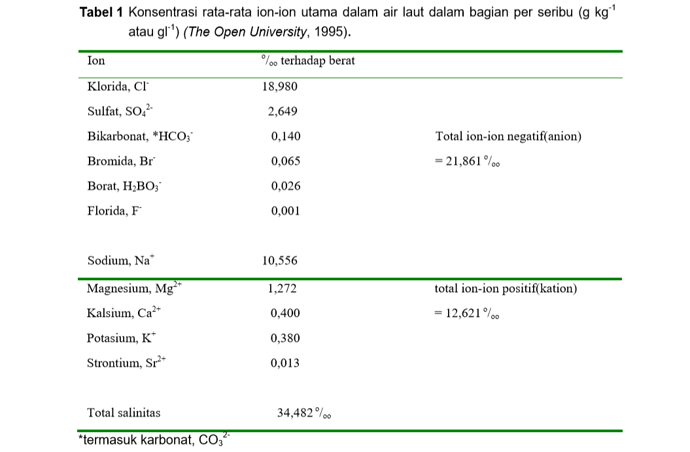
Konsentrasi rata-rata garam terlarut di lautan (S) adalah 3,5% terhadap berat. Pada tabel 1 terdapat daftar 11 ion utama yang membentuk 99,9% unsur terlarut air larut. (Dalam banyak hal konsentrasi dinyatakan sebagai bagian per seribu atau gram per kg (g/kg) atau gram per liter (g/l) diasumsikan sebagai satu liter air laut seberat satu kg).
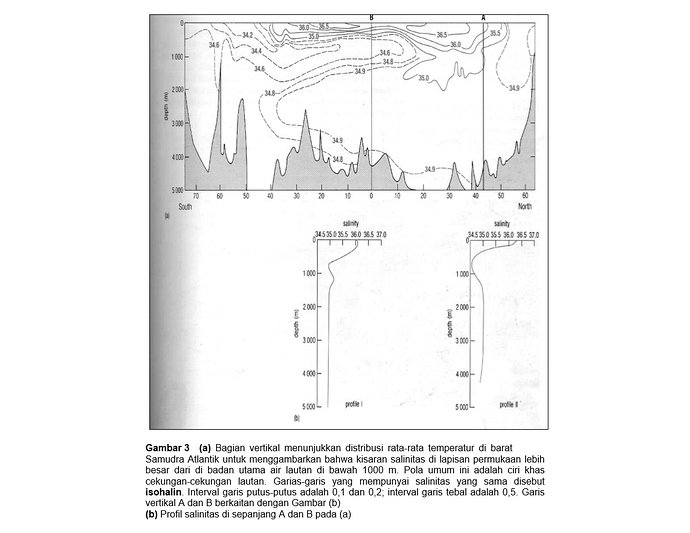
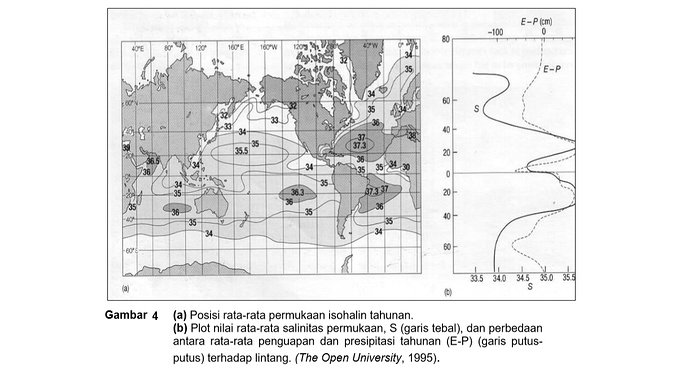
Dalam air permukaan lautan, kisaran salinitas adalah 33-37 tetapi pada paparan-paparan laut dan kondisi lokal, kisaran dapat melebar menjadi 28-40 atau lebih. Air payau mempunyai salinitas kurang dari 25 sementara air hipersalin lebih besar dari 40.
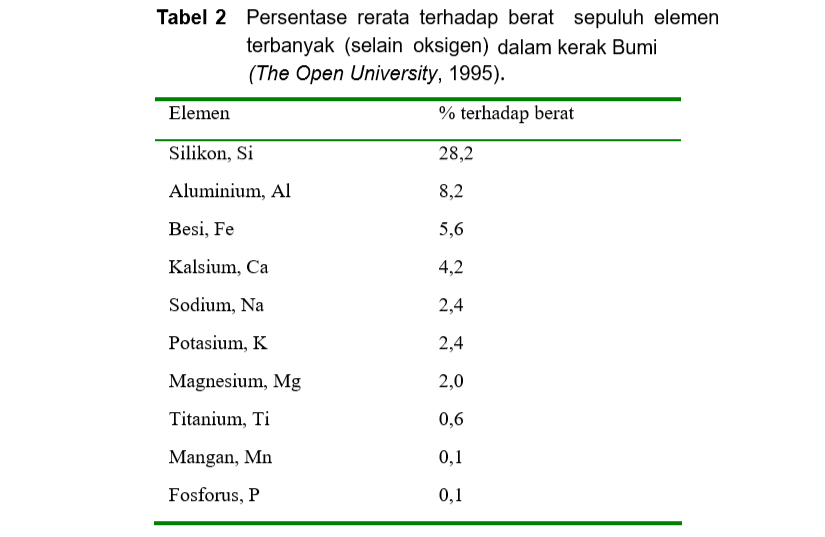
Tabel 2 di bawah menunjukkan komposisi elemen batuan kerak yang menunjukkan kontras apabila dibandingkan dengan komposisi lautan. Hal ini menunjukkan bahwa operasi siklus hidrologi menghasilkan sebagian besar unsur terlarut dalam air laut. Walaupun demikian, sejak akhir 1970-an, oseanografi mengetahui bahwa terdapat kontribusi lain terhadap komposisi air laut, yaitu sirkulasi hidrotermal di puncak punggungan samudra.
Kekonstanan Komposisi
Komposisi air laut yang konstan adalah konsep penting dalam oseanografi. Untuk Tabel 1 berlaku konsep berikut:
Konsentrasi ion-ion terlarut utama bervariasi menurut tempat di lautan tetapi proporsi relatifnya tetap konstan.
Dengan kata lain, salinitas total dapat berubah tetapi rasio konsentrasi ion utama tertentu tetap konstan dan begitu juga rasio konsentrasi individu ionion utama. Salinitas bervariasi tergantung keseimbangan antara penguapan dan presipitasi, serta besarnya pencampuran antara air permukaan dan air di kedalaman.
Secara umum, perubahan salinitas tidak mempengaruhi proporsi relatif ion-ion utama. Konsentrasi ion-ion berubah dalam proporsi yang sama yaitu rasio ioniknya tetap konstan. Dengan pengecualian terhadap generalisasi di atas, terdapat variasi rasio kalsium dan bikarbonat yang relatif kecil karena keterlibatan unsur tersebut dalam proses biologi di mana rasio Ca2+ dan HCO3- pada salinitas adalah 0,5% dan 10-20% lebih besar di kedalaman dari pada dalam air permukaan.
Perubahan Akibat Kondisi Lokal
Untuk beberapa lingkungan laut, terdapat kondisi di mana rasio-rasio ion menyimpang jauh dari normal. Daerah tersebut termasuk:
-
Laut-laut tertutup, estuari dan daerah lain dimana terdapat aliran sungai yang besar yang mengandung lebih sedikit total garam terlarut dari air laut serta mempunyai rasio ion yang berbeda
-
Cekungan, fjord dan daerah lain dimana sirkulasi dasar sangat terbatas, misalnya dengan keberadaan sill (batas sub-permukaan) di mulut cekungan akan menghadang kontak bebas antara air dasar dan air laut beroksigen di luarnya. Dalam kasus-kasus tersebut, hancuran bakteri (oksidasi) dari bahan organik di dasar air menyebabkan kekurangan oksigen terlarut yang cukup parah, yang menyebabkan terjadinya kekurangan total yang disebut anoksik atau anaerobik. Anion sulfat digunakan sebagai sumber alternatif oksigen oleh organisme mikro.
-
Daerah yang luas, hangat dan dangkal seperti Bahama Banks yang dicirikan oleh presipitasi biologi kalsium karbonat yang sangat aktif secara kimiawi dan/atau biologi menyebabkan perubahan yang signifikan pada rasio Ca2+ terhadap salinitas total.
-
Daerah-daerah tempat terjadinya pemekaran dasar laut dan aktivitas vulkanik aktif bawah laut, di mana air laut panas bersirkulasi di kerak samudra. Rasio ion dalam larutan hidrotermal sangat berbeda dari air laut yang normal, yang menghasilkan percampuran dengan air laut mempunyai ciri elemen utama: rasio-rasio salinitas.
-
Di dalam sedimen dasar laut di mana air pori yang turut dalam berbagai reaksi di dalam partikel sedimen pada saat kompaksi setelah sedimen diendapkan. Reaksi tersebut muncul sebagai diagenesis dan menyebabkan perubahan rasio ion yang cukup berarti.
Garam dari Air Laut
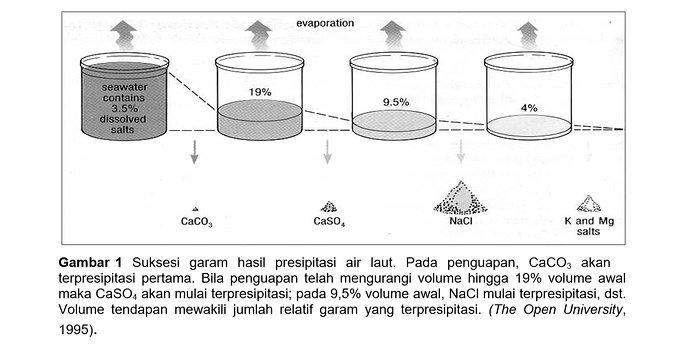
Dengan penguapan air laut, garam dengan daya larut paling rendah akan mencapai titik jenuh pertama kali, sehingga urutan presipitasi berdasarkan peningkatan solubilitas dan bukan terhadap banyaknya. Tahapan tersebut ditunjukkan dalam Gambar 1 berkaitan dengan proporsi relatif garam yang mengalami presipitasi. Unsur pertama yang mengalami presipitasi adalah kalsium karbonat (CaCO3) yang membentuk sedikit garam karena kurangnya endapan ion-ion bikarbonat (karbonat).
Kalsium sulfat dipresipitasi sebagai anhidrit (CaSO4) atau sebagai gipsum (CaSO4.2H2O), tergantung kondisi. Sodium klorida (halit, NaCl) adalah garam terbanyak dan residu air garamnya mengandung klorida potasium dan magnesium yang merupakan unsur yang paling larut sehingga menjadi yang terakhir dipresipitasi.
Secara umum tiap negara pantai dapat memproduksi garam laut secara komersil dan setidaknya ada 60 negara yang masih melakukannya, baik melalui proses industri maupun dengan penguapan tradisional (Gambar 2).
Terdapat 40 juta ton sodium klorida diekstrak dari air laut tiap tahun secara intensif, antara lain untuk konsumsi manusia tetapi kebanyakan adalah untuk manufaktur kimia. Magnesium hidroksida adalah hasil presipitasi kimia dari air laut dan digunakan untuk menghasilkan 600.000 ton magnesium dan senyawanya tiap tahun. Produksi Bromin sebesar 30.000 ton yang dihasilkan secara elektrolisis sebagai suatu gas dan kemudian dikondensasi menjadi cair. Metode ekstraksi litium (Li) dari air laut dikembangkan di akhir tahun 1980-an.
Kebanyakan elemen terlarut dalam air laut mempunyai konsentrasi yang kecil tetapi total volume air laut sangat besar sehingga jumlahnya sangat besar dan usaha mengekstrakkan elemen-elemen berharga seperti emas dan uranium telah dilakukan berkali-kali; tetapi belum ada teknik yang ekonomis.