Tanpa kita sadari, kita hidup berdampingan dengan beragam fenomena yang berkaitan dengan ilmu termodinamika. Namun tentunya, banyak yang masih gak terlalu ngerti atau bahkan denger nama termodinamika baru sekali ini. Nah, sebenarnya apa sih termodinamika itu?
Oke kalo ngebahas tentang fenomena fenomena alam yang hidup berdampingan kita itu banyak banget, salah satunya yang berkaitan dengan keilmuan termodinamika. Oke, pertama kita mesti paham dulu apa itu termodinamika,
Pengertian Termodinamika
Termodinamika adalah ilmu yang mempelajari suhu dan perpindahan kalor serta akibat-akibatnya. Pemahaman tentang termodinamika tidak terlepas dari suatu pendapat bahwa terdapat kualitas skalar yang dinamakan suhu. Untuk memahami konsep suhu, kita perlu mendefinisikan dua istilah yang sering digunakan yaitu kontak termal dan keseimbangan termal. Kontak termal terjadi apabila ada dua atau lebih benda yang saling berinteraksi dengan cara saling bertukar energi diantara benda benda tersebut yang diakibatkan oleh perbedaan suhu.
Summary
(Raymond A. Serway, John W. Jewett, Jr. 2010:4)
Aplikasi Termodinamika
Dalam keidupan sehari hari, kita acap kali menemukan barang barang yang menerapkan prinsip termodinamika. Berikut beberapa contohnya :
- Mesin kendaraan bermotor
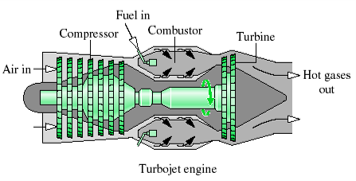
- Turbin pesawat
- Kompresor dan pompa
- Kulkas
- Air Conditioner
Hukum hukum termodinamika
- Hukum termodinamika 1
Ketika kita membahas tentang energi, maka sangat penting mempelajari tentang hukum kekekalan energi. Perubahan energi dalam pada sistem adalah sama dengan jumlah dari semua perpindahan energi yang melewati batas sistem. Hukum pertama Termodinamika adalah salah satu contoh khusus dari hukum kekekalan energi yang meliputi perubahan energi berupa energi dalam, kalor, dan usaha. Ini adalah hukum yang dapat diterapkan pada banyak proses dan menghubungkan dunia mikroskopis dengan dunia makroskopis.
Ada dua cara energi dapat dipindahkan antara sistem dan lingkungannya. Yang pertama adalah usaha yang dilakukan pada sistem, yang mengharuskan adanya perpindahan secara makroskopis dari titik kerja gayanya. Yang kedua akan ada kalor yang mengalir dan terjadi pada level molekuler, yaitu ketika ada perbedaan suhu melintasi batas sistem. Kedua mekanisme tersebut menghasilkan perubahan energi dalam dari sistem dan karena itu biasanya menghasilkan perubahan yang dapat diukur pada variabel makroskopis dari sistem, seperti tekanan, suhu, dan volume gas.
Untuk lebih memahami tentang hal ini, maka dicontohkan dengan sebuah sistem yang mengalami perubahan dari keadaan awal ke keadaan akhir. Selama perubahan ini, terjadi perpindahan energi berupa kalor Q yang memasuki sistem, dan usaha W dilakukan pada sistem. Sebagai contoh, misalkan sistemnya adalah gas, yang tekanan dan volumenya berubah dari Pi dan Vi menjadi Pf dan Vf . Jika jumlah Q + W diukur untuk berbagai lintasan yang menghubungkan keadaan awal dan keadaan akhir yang seimbang, kita menemukan bahwa jumlahnya sama untuk semua lintasan yang menghubungkan kedua keadaan tersebut.
Kita simpulkan bahwa Q + W ditentukan oleh tahap awal dan akhir dari sistem, kita menyebut besaran ini sebagai perubahan energi dalam pada sistem. Meskipun Q dan W bergantung pada lintasannya, jumlah Q + W tidak bergantung pada lintasan tersebut. Jika kita memakai simbol ∆ U untuk merepresentasikan energi dalam maka perubahan energi dalam
dirumuskan :
∆ U = Q+W (2.1)
Rumus di atas mempunyai satuan yang sama yaitu satuan energi. Rumus di atas dikenal sebagai hukum pertama termodinamika.
Salah satu konsekuensi dari hukum pertama Termodinamika adalah adanya energi dalam yang nilainya ditentukan oleh keadaan sistem. Energi dalam adalah variabel keadaan, seperti tekanan, volume dan suhu. Ketika sistem mengalami perubahan yang teramat kecil dimana sejumlah kecil energi dQ dipindahkan dan usaha dW yang kecil dilakukan pada sistem tersebut, energi dalam berubah dalam jumlah dUdalam yang kecil. Sehingga untuk proses dengan nilai yang sangat kecil, hukum pertama termodinamika dapat dituliskan sebagai berikut :
dUdalam = dQ+dW (2.2)
Hukum pertama termodinamika adalah sebuah persamaan dari hukum kekekalan energi yang menyatakan bahwa satu-satunya jenis energi yang berubah dalam sistem adalah energi dalam. Besaran usaha dalam rumus ke-1 termodinamika dapat berasal dari energi listrik, energi potensial, energi kinetik dan bentuk energi lainnya selain energi kalor dan energi dalam. Jika usahanya dalam bentuk energi listrik, maka rumusnya adalah:
W = V I t (2.3)
dengan:
V = Tegangan Listrik (Volt)
I = Arus listrik (Ampere)
t = Waktu (Sekon)
Sehingga dapat disimpulkan bahwa energi dalam berkaitan dengan energi dari partikel-partikel penyusun zat dari sistem dan dapat dihubungan dengan besaran-besaran mikroskopis dari sistem, sedangkan energi kalor berkaitan dengan besaran-besaran makroskopis sistem seperti tekanan, volume, dan suhu dari sistem.
- Hukum 2 termodinamika
Hukum pertama termodinamika, merupakan pernyataan tentang kekekalan energi. Hukum ini menyatakan bahwa perubahan energi dalam pada sistem disebabkan perpindahan energi berupa kalor, usaha, ataupun keduanya. Hukum ini tidak membedakan antara hasil dari kalor dan usaha, sehingga baik kalor maupun usaha dapat menyebabkan perubahan energi dalam. Meskipun demikian, sebenarnya terdapat perbedaan penting antara kalor dan usaha yang tidak tampak jelas dari hukum pertama
termodinamika. Salah satu wujud perbedaan ini adalah bahwa kita tidak mungkin membuat alat yang bekerja secara siklis, menerima energi kalor dan mengeluarkan sejumlah energi yang sama besar dalam bentuk usaha
Summary
(Raymond A. Serway dan John W. Jewett, Jr, 2010: 130).
Dibawah ini definisi dari hukum ke-2 termodinamika oleh Rudolf Clusius tentang aliran kalor
Summary
(Raymond A. Serway dan John W. Jewett, Jr, 2010: 134)
“Tidak mungkin membuat sebuah mesin siklis yang efek tunggalnya adalah memindahkan energi berupa kalor secara terus- menerus dari satu benda ke benda lain yang suhunya lebih tinggi tanpa adanya masukan energi berupa usaha”. Berikut ini adalah beberapa contoh proses yang diatur oleh hukum kedua termodinamika:
Jika dua buah benda yang berbeda suhunya saling bersentuhan, perpindahan energi berupa energi kalor akan selalu dari benda yang lebih panas ke benda yang lebih dingin secara spontan, tidak pernah dari benda yang lebih dingin ke benda yang lebih panas.
Sebuah bola karet yang dijatuhkan ke tanah akan memantul beberapa kali dan pada akhirnya berhenti, tetapi sebuah bola yang diam diatas tanah tidak pernah mengumpulkan energi dalam dari tanah dan memantul sendiri.
Sebuah bandul yang bergoyang akhirnya berhenti akibat tumbukan dengan molekul udara dan gesekan pada titik tumpunya. Energi mekanik sistem diubah menjadi energi termal pada udara, bandul dan gantungannya, tetapi perubahan energi kearah sebaliknya tidak pernah terjadi.
Sebuah mesin kalor membawa suatu zat kerja melalui proses siklis dimana zat kerja menyerap energi berupa kalor dari reservoir bersuhu tinggi, kemudian mesin melakukan usaha, akhirnya energi berupa kalor dikeluarkan menuju reservoir rendah. Sebagai contohnya adalah mesin uap yang menggunakan air sebagai zat kerja. Air didalam ketel menyerap energi dari bahan bakar dan menguap, yang kemudian uap itu melakukan usaha dengan mengembang melawan sebuah piston. Setelah uap mendingin dan mengembun, air yang dihasilkan kembali ke ketel dan siklusnya berulang.
Sedangkan contoh lain adalah sebuah mesin yang menyerap sejumlah energi Qh dari reservoir panas, mesin melakukan usaha sebesar Wusaha (jika usaha bernilai negatif maka usaha dilakukan pada mesin) dan kemudian memberikan sejumlah energi Qc ke reservoir dingin. Dibawah ini
adalah cara kerja dari sebuah mesin kalor sesuai dengan prinsip yang dikemukakan oleh Kelvin-Plank
Summary
(Raymond A. Serway dan John W. Jewett, Jr, 2010: 133)
“Kita tidak mungkin menciptakan sebuah mesin kalor yang bekerja secara siklis tidak menghasilkan efek lain selain energi yang masuk berupa kalor dari sebuah reservoir dan kinerja dengan usaha yang besarnya sama”. Usaha yang dilakukan mesin kalor dapat dirumuskan sebagai berikut:
Wmesin = Qh – Qc (2.4)
Dengan:
Wmesin = Usaha yang dilakukan oleh mesin (J)
Qh = Kalor yang keluar dari reservoir suhu tinggi (J)
Qc = Kalor yang masuk pada reservoir suhu rendah (J)