
Apa yang dimaksud dengan Spektrum Atom Hidrogen?

Apa yang dimaksud dengan Spektrum Atom Hidrogen?
Teori atom Rutherford walaupun lebih baik dari model atom Thomson karena ditunjang oleh hasil eksperimen, tidak dapat menjelaskan spektrum cahaya yang dipancarkan oleh atom hidrogen.
Sebuah elektron akan tetap di salah satu orbitnya, apabila tidak ada energi yang diradiasikan. Apabila diberi radiasi elektron akan berpindah ke lintasan yang lain. Berpindahnya elektron dari lintasan tertentu ke lintasan yang lain menghasilkan gelombang elektromagnetik dengan panjang gelombang tertentu yang harganya berada di antara daerah infra merah dan ultra violet. Gelombang ini menghasilkan garis-garis spektrum yang mengumpul dalam suatu deret spektrum.
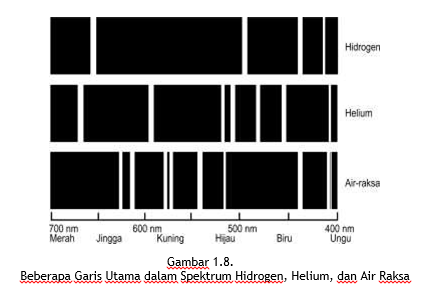
Seperti kita ketahui jika pada sebuah prisma dipancarkan seberkas cahaya maka akan didispersikan menjadi suatu spektrum. Apabila sumber cahayanya zat padat atau zat cair yang berpijar, spektrum yang dihasilkan adalah kontinu, artinya cahaya dengan semua panjang gelombang muncul dalam spektrum tersebut. Apabila sumber cahayanya berupa gas yang berpijar, spektrumnya mempunyai sifat yang berbeda dan menjadi beberapa warna saja dalam bentuk garis-garis paralel yang terisolasi satu sama lain. Spektrum jenis ini disebut spektrum garis emisi. Panjang gelombang garis-garis ini ditentukan oleh elemen yang mengemisikan cahaya tersebut. Hidrogen memberikan himpunan garis-garis tertentu pada posisi yang sama, helium menghasilkan himpunan yang lain, air raksa menghasilkan himpunan yang lain lagi dan seterusnya. Spektrum garis emisi hidrogen, helium, dan air raksa ditunjukkan pada Gambar 1.8.
Pada mulanya sangat sulit menentukan sifat atau rumus yang dapat menggambarkan frekuensi pada sebuah grup cahaya yang timbul pada spektrum garis tersebut. Pada akhir abad XIX dalam suatu eksperimen ditemukan bahwa panjang gelombang dalam setiap deret spektrum dapat dispesifikasikan dengan rumus empiris yang sederhana dan dapat menjelaskan frekuensi gelombang yang dipancarkan oleh hidrogen. Deret spektrum ini pertama kali ditemukan oleh J.J. Balmer (1885) ketika ia mempelajari bagian tampak dari spektrum hidrogen. Spektrum ini terlihat pada daerah cahaya tampak yang dapat dengan jelas teramati. Dari pengamatan ternyata garis-garis menjadi makin rapat dan akhirnya terkumpul bersama-sama pada batas deretan garis-garis tersebut, seperti ditunjukkan pada Gambar 1.9.
Rumus Balmer untuk panjang gelombang dalam deret tersebut adalah
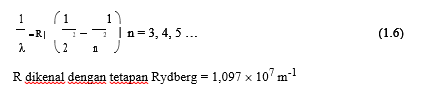
Garis spektrum yang terjadi pada deret Balmer dengan panjang gelombang terbesar 656,3 nm (disebut H) berwarna merah dan secara berturut-turut di sebelahnya dengan panjang gelombang 486,3 nm (disebut H) berwarna biru. Panjang gelombang 434,1 nm (disebut H) berwarna ungu, dan panjang gelombang 364,6 nm (disebut H berwarna ultra ungu. Ketika panjang gelombangnya bertambah kecil, garis yang didapatkan bertambah berdekatan dan intensitasnya lebih lemah. Di luar batas itu tidak terdapat lagi garis yang terpisah, hanya terdapat spektrum kontinu yang lemah.
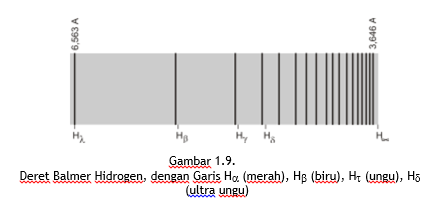
Garis H bersesuaian dengan n = 3, garis H dengan n = 4, garis H dengan n = 5 dan seterusnya. Batas deret bersesuaian dengan n = ~ sehingga pada saat itu panjang gelombangnya adalah 4/R sesuai dengan hasil eksperimen.
Di sini jelas bahwa frekuensi-frekuensi yang timbul pada deret Balmer ini disebabkan oleh adanya perpindahan letak elektron dari lapisan kulit yang ke 3, 4, 5 …. dan seterusnya ke lapisan kulit yang ke-2 pada susunan atom
Hidrogen. Hal ini berarti bahwa bila sebuah elektron pada kulit ke-3 atom Hidrogen pindah ke kulit ke-2 maka akan terpancar foton dengan panjang gelombang H yaitu 656,3 nm (cahaya merah). Deret Balmer hanya berisi panjang gelombang pada bagian tampak dari spektrum hidrogen. Garis spektrum hidrogen dalam daerah ultra ungu dari infra merah jatuh pada beberapa deret lain.
Deret Lyman mempunyai spektrum ultra ungu hasil loncatan elektron dari orbit n>1 ke orbit n=1, dengan panjang gelombang:

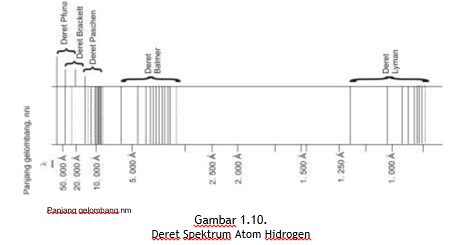
Berdasarkan Gambar 1.10 tersebut bahwa deret Brackett bertumpang tindih dengan deret Paschen dan Pfund, berada pada daerah infra merah. Keteraturan yang terjadi dalam struktur atom hidrogen dan atom yang lebih kompleks, membuka peluang pengujian teori struktur atom yang kemudian dikembangkan oleh Niels Bohr.