Myoglobin adalah contoh klasik dari struktur tersier protein sedangkan hemoglobin adalah contoh dari struktur quartener protein. Myoglobin adalah protein pertama yang diketahui struktur tersier lengkapnya. Struktur tersier myoglobin ditentukan dengan kristalografi sinar-X. Myoglobin dan hemoglobin merupakan protein globular. Kedua protein ini melakukan fungsi biologi mengikat molekul oksigen secara selektif dan reversibel. Myoglobin merupakan protein monomer kecil yang memudahkan difusi oksigen pada otot vertebrata. Myoglobin merespon penyediaan oksigen ke jaringan otot reptil, burung dan mamalia. Hemoglobin adalah protein tetramer yang lebih besar yang membawa oksigen dalam darah. Bagaimana orientasi satu rantai dengan rantai lainnya pada hemoglobin? Bagaimana bentuk keseluruhan dari protein fungsional finalnya?
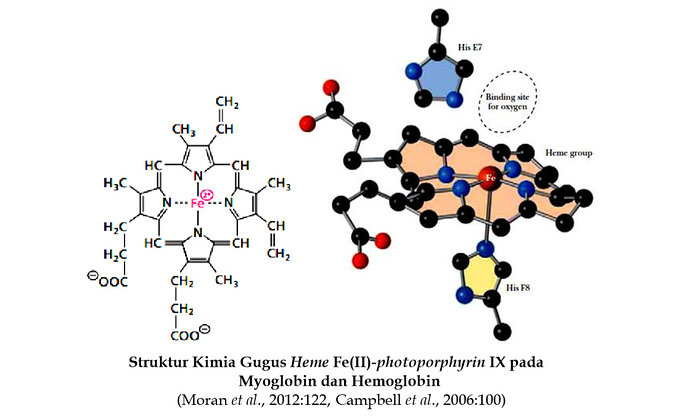
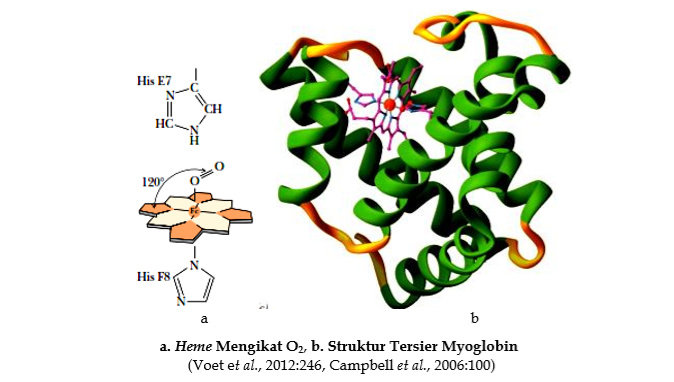
Warna merah berhubungan dengan bentuk teroksigenasi dari myoglobin dan hemoglobin (misalnya warna merah dari darah yang teroksigenasi) disebabkan oleh gugus prostetik heme mengikat oksigen. Hadirnya heme ini pada myoglobin dan hemoglobin dibutuhkan untuk mengikat oksigen. Heme terdiri dari sistem cincin tetrapyrrole (photoporphyrin IX) yang membentuk kompleks dengan besi.
Empat cincin pyrrol dari sistem ini berikatan dengan methene (-CH=) agar porphyrin tidak jenuh terkonjugasi tinggi dan planar. Besi yang terikat dalam keadaan oksidasi ferrous (Fe2+). Ferrous membentuk kompleks dengan 6 ligan, 4 atom nitrogen dari protoporphyrin IX. Cincin porphyrin menyediakan 4 dari 6 ligan yang mengelilingi atom besi.
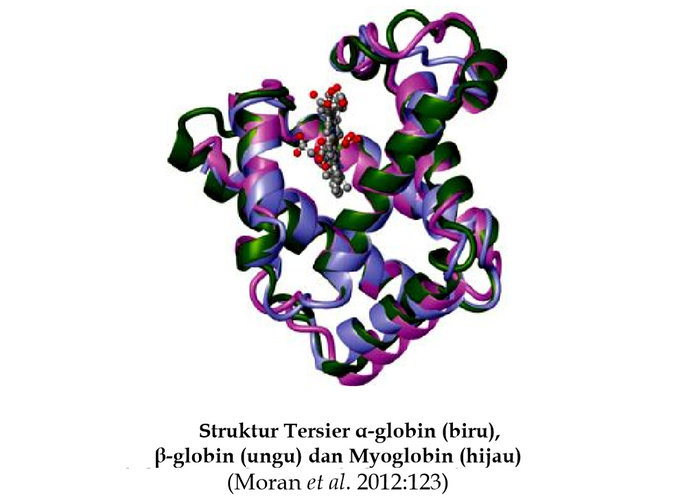
Myoglobin adalah anggota famili protein yang dinamakan globin. Struktur tersier myoglobin memperlihatkan bahwa pada protein ini terdapat 8 bagian daerah α-helix yang ditandai dengan huruf A sampai H dan tidak mempunyai daerah β-sheet. Bagian α-helix ini dihubungkan oleh loop dan turn. Sekitar 75% residu asam amino pada myoglobin ditemukan di daerah α-helix. Ikatan hidrogen pada backbone polipeptida menstabilkan daerah α - helix, rantai samping asam amino juga terlibat dalam ikatan hidrogen. Rantai samping dari residu asam amino polar mengarah ke luar molekul myoglobin. Pada bagian interior protein mengandung hampir semuanya residu asam amino nonpolar khususnya yang hidrofobik tinggi seperti valin, leusin, isoleusin, penilalanin dan metionin. Dua residu histidin polar (posisi His E7 dan His F8) ditemukan pada interior molekul. Rantai samping residu asam amino ini dilibatkan pada interaksi dengan gugus heme dan pengikatan oksigen. Dengan demikian residu asam amino ini memainkan peran penting pada fungsi molekul myoglobin. Hadirnya gugus heme mempengaruhi konformasi polipeptida. Apoprotein (polipetida tanpa gugus prostetik heme) tidak dilipat erat sebagai molekul yang sempurna.
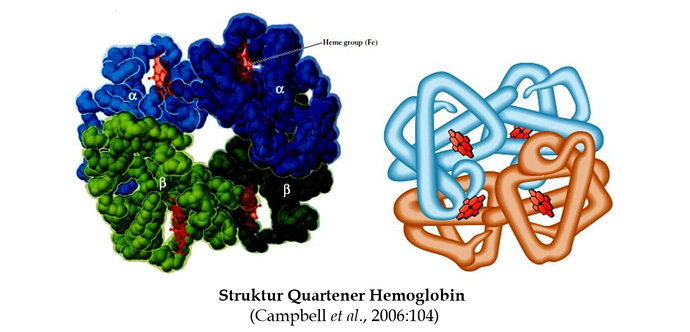
Pada vertebrata, molekul O2 diikat hemoglobin untuk ditranspor dalam sel darah merah, atau eritrosit. Pada sebuah eritrosit manusia terdapat sekitar 3 x 10^8 molekul hemoglobin. Hemoglobin lebih kompleks dibanding myoglobin karena hemoglobin merupakan protein multisubunit. Hemoglobin merupakan tetramer dari empat subunit polipeptida yaitu dua sub unit α-globin dan dua sub unit β-globin. Dengan demikian struktur keseluruhan hemoglobin ditulis α2β2.
Struktur tersier α-globin, β-globin dari hemoglobin sangat mirip dengan struktur tersier myoglobin. Panjang rantai α - globin adalah 141 residu asam amino, sedangkan rantai β-globin adalah 146 residu asam amino. Sebagai perbandingan panjang rantai myoglobin adalah 153 residu asam amino. Kebanyakan asam amino dari rantai α-globin, rantai β-globin pada hemoglobin dan myoglobin adalah homologous yang berarti bahwa residu asam amino sama pada posisi yang sama. Setiap subunit pada 4 globin dari hemoglobin mengandung gugus protetik heme yang identik seperti yang terdapat pada myoglobin. Oleh sebab itu, struktur tersier dari α-globin, β-globin dari hemoglobin hampir identik dengan myoglobin. Pada hemoglobin, rantai α-globin mempunyai tujuh α-helix dan rantai β-globin mempunyai delapan α-helix. Setiap rantai α berinteraksi secara luas dengan rantai β mengakibatkan hemoglobin seperti sebuah dimer dari subunit αβ. Dengan demikian, setiap molekul hemoglobin memiliki 4 gugus prostetik heme. Gugus heme ini berfungsi untuk mengikat oksigen. Berapa buah molekul oksigen yang dapat diikat oleh setiap molekul hemoglobin?
Myoglobin mempunyai fungsi penyimpan oksigen di dalam otot. Myoglobin harus berikatan kuat dengan oksigen pada tekanan yang sangat rendah. Myoglobin 50% jenuh pada tekanan parsial oksigen 1 torr. Fungsi hemoglobin adalah pembawa oksigen. Hemoglobin harus dapat mengikat oksigen dengan kuat dan melepaskan oksigen dengan mudah tergantung kondisi. Pada paru-paru (di mana hemoglobin harus mengikat oksigen untuk ditransport ke jaringan), tekanan oksigen adalah 100 torr. Pada tekanan ini hemoglobin 100% jenuh dengan oksigen. Pada kapiler dari otot yang aktif, tekanan oksigen adalah 20 torr. Pada keadaan ini hemoglobin kurang 50% jenuh dengan oksigen (hemoglobin 50% jenuh oksigen terjadi pada 26 torr). Dengan kata lain, hemoglobin memberikan oksigen dengan mudah di dalam kapiler, dimana oksigen dibutuh kan besar.
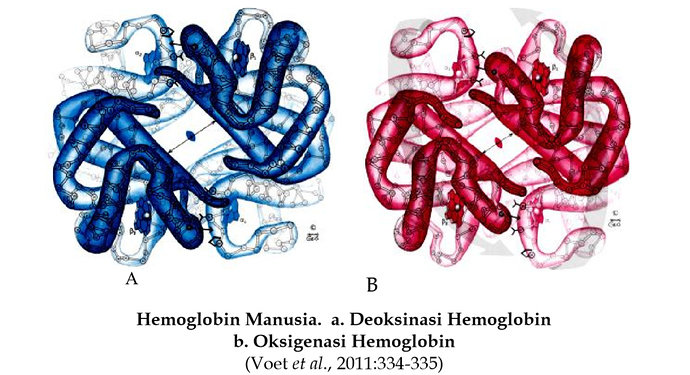
Perubahan struktur selama pengikatan molekul kecil adalah karakteristik dari protein allosterik seperti molekul hemoglobin. Hemoglobin mempunyai bentuk struktur quartener yang berbeda ketika sedang mengikat oksigen (teroksigenasi) dan tidak mengikat oksigen (deoksigenasi). Dua rantai-β lebih rapat satu sama lain pada hemoglobin teroksigenasi dibandingkan pada hemoglobin deoksigenasi. Perubahan ini ditandai pada dua bentuk hemoglobin yang mempunyai struktur kristal yang berbeda. Dengan demikian, hemoglobin mempunyai struktur quartener yang berbeda ketika mengikat oksigen dan tidak mengikat oksigen.
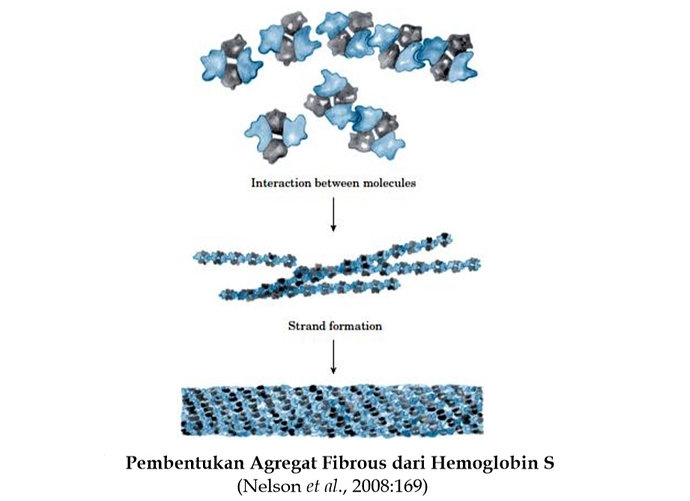
Perubahan struktur quartener hemoglobin dapat menurunkan fungsinya sebagai pengikat molekul oksigen. Hal ini dapat diamati pada hemoglobin sel sabit yang penyakitnya dikenal sebagai anemia sel sabit. Anemia sel sabit adalah penyakit genetik manusia yang pertama kali muncul di daerah tropis Barat dan Afrika tengah. Individu ini menghasikan hemoglobin yang termutasi yang dikenal sebagai hemoglobin sel sabit (Hb S). Nama anemia sel sabit muncul karena sel darah merah seperti “sabit”. Sel “sabit” tidak dapat melewati kapiler kecil, akibatnya merusak banyak organ khususnya tulang dan ginjal yang dapat mengakibatkan kematian.
Hemoglobin sel sabit berbeda dari hemoglobin normal hanya oleh asam amino tunggal. Sebuah valin (asam amino hydrophobik) pada rantai-β dari hemoglobin sel sabit telah menggantikan sebuah asam glutamat (asam amino bermuatan negatif) pada posisi ke-6. Substitusi ini menyebabkan pengikatan molekul hemoglobin S ke molekul hemoglobin S lainnya ketika oxyhemoglobin S melepaskan oksigennya. Molekul berasoasiasi abnormal satu sama lain membentuk agregat fibrous panjang yang merupakan karakteristik hemoglobin S ini. Molekul-molekul ini berikatan seperti jaringan polimer panjang. Hal ini terjadi karena valin cocok masuk ke kantong hidrofobik pada permukaan dari molekul deoxyhemoglobin S kedua.