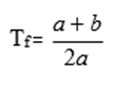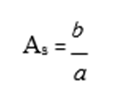Pemisahan hasil ekstraksi tumbuhan terutama dilakukan dengan salah satu atau gabungan dari beberapa teknik kromatografi. Pemilihan teknik kromatografi sebagian besar bergantung pada sifat kelarutan dan keatsirian senyawa-senyawa yang akan dipisahkan.
Kromatografi adalah suatu metode fisik untuk pemisahan yang didasarkan atas perbedaan afinitas senyawa-senyawa yang sedang dianalisis terhadap dua fasa yaitu fasa stasioner/fasa diam dan fasa mobil/fasa gerak.
Jadi, campuran senyawa-senyawa dapat mengalami adsorpsi dan desorpsi oleh fasa dalam secara berturut-turut sehingga secara berurutan fasa gerak juga akan melarutkan senyawa-senyawa tersebut dan proses pemisahan dapat terjadi karena campuran senyawa memiliki kelarutan yang berbeda di antara dua fasa tersebut.
Fasa diam yang digunakan dalam kromatografi dapat berupa zat padat juga berupa zat cair. Silika dan alumina merupakan contoh zat padat yang sering digunakan sebagai fasa diam berkat kemampuannya dalam mengadsorpsi bahan-bahan yang akan dipisahkan (sebagai adsorben).
Keduanya dapat digunakan sebagai bahan pengisi kolom pada kromatografi kolom gravitasi, kromatografi tekanan tinggi dan juga sebagai bahab pembuat lapis tipis untuk KLT. Fasa diam dapat juga berupa zat cair dengan fasa pendukung yang berupa zat padat. Salah satu contoh adalah pada kromatografi kertas dimana fasa diamnya berupa air yang diadsorpsi oleh molekul-molekul selulosa pada kertas (kertas adalah fasa pendukung), sedangkan pada kromatografi gas fasa diam berupa zat padat yang dilekatkan pada kapiler yang stabil terhadap suhu dan fasa diam ini mempunyai pori dan ukuran yang sama.
Fasa gerak dapat berupa gas pada kromatografi gas, dapat juga berupa zat cair seperti pada kromatografi kertas, kromatografi lapis tipis atau kromatografi kolom. Jika fasa mobil berupa gas, maka dinamakan gas vektor/gas pembawa, sedangkan jika berupa zat cair dinamakan eluen/pelarut.
Berdasarkan keadaan/sifat fasa-fasa yang digunakan, dapat dibedakan beberapa jenis kromatografi, antara lain;
- Kromatografi cair-padat, dengan fasa gerak cair dan fasa diam padat
- Kromatografi gas-padat, dengan fasa gerak gas dan fasa diam padat
- Kromatografi cair-cair, dengan fasa gerak cair dan fasa diam cair
- Kromatografi gas-cair, dengan fasa gerak gas dan fasa diam cair
Kromatografi gas-padat dan kromatografi gas-cair sering disebut kromatografi gas (GC). Berdasarkan sifat fenomena yang terjadi pada pemisahan, dapat dibedakan dengan kromatografi adsorpsi, kromatografi partisi, kromatografi lapis penukar ion, kromatografi afinitas/filtrasi gel. Berdasarkan teknik pemisahan, dibedakan menjadi kromatografi lapis tipis (KLT), romatografi kertas, kromatografi kolom (KK), kromatografi gas, krmatografi cair bertekanan tinggi. Metode pemisahan yang sering digunakan adalah KLT dan KK.
1. Kromatografi Lapis Tipis (KLT)
Fenomena yang terjadi pada KLT adalah berdasar pada prinsip adsorpsi. Setelah sampel ditotolkan di atas fasa diam, senyawa-senyawa dalam sampel akan terelusi dengan kecepatan yang sangat bergantung pada sifat senyawa-senyawa tersebut (kemampuan terikat pada fasa diam dan kemampuan larut dalam fasa gerak), sifat fasa diam (kekuatan elektrostatis yang menarik senyawa di atas fasa diam) dan sifat fasa gerak (kemampuan melarutkan senyawa). Pada KLT, secara umum senyawa-senyawa yang memiliki kepolaran rendah akan terelusi lebih cepat daripada senyawa-senyawa yang memiliki kepolaran rendah akan terelusi lebih cepat daripada senyawa-senyawa polar karena senyawa polar terikat lebih kuat pada bahan silika yang mengandung silanol (SiOH2) yang pada dasarnya memiliki afinitas yang kuat terhadap senyawa polar.
Karena prosesnya yang mudah dan cepat, KLT banyak digunakan untk melihat kemurnian suatu senyawa organik. Jika analisis dilakukan dengan mengubah pelarut beberapa kali (minimum 3 macam) dan hasil elusi tetap menampakkan satu noda maka dapat dikatakan bahwa sampel yang ditotolkan adalah murni. Selain itu, karena KLT juga dapat menampakkan jumlah senyawa-senyawa dalam campuran sampel (menurut noda yang muncul), maka KLT dapat digunakan untuk mengikuti atau mengontrol jalannya reaksi organik maupun untuk mengontrol proses pemisahan campuran yang dilakukan menggunakan kromatografi kolom. KLT juga merupakan suatu cara yang umum dilakukan untuk memilih pelarut yang sesuai sebelum dilakukan pemisahan menggunakan kromatografi kolom. Jadi, secara ringkas KLT terutama berguna untuk tujuan mencari pelarut yang sesuai untuk kromatografi kolom, analisis fraksi-fraksi yang diperoleh dari kromatografi kolom, memonitor jalannya suatu reaksi kimia, identikasi senyawa (uji kemurnian).
Beberapa kelengkapan KLT adalah bejana kromatografi yang biasanya terbuat dari kaca dengan bentuk yang bervariasi dan harus dilengkapi dengan penutup yang rapat, fasa diam yang berupa selapis tipis (0,25 mm) silika gel atau adsorben yang lain (alumina, selulosa, kieselguhr) yang dilapiskan di atas sepotong kaca, plastik atau aluminium dengan abntuan sebuah penghubung sepert CaSO4 anhidrat, tepung kanji atau suatu polimer organik, sampel sebanyak 1 µl dari larutan encer (2-5%) suatu campuran yang ditotolkan pada satu titik di atas fasa diam (dengan bantuan suatu pipa kapiler) dan titik tersebut letaknya juga di atas batas pelarut. Jika konsentrasi sampel yang ditotolkan terlalu tinggi akan menyebabkan terjadinya tailing.
Oleh karena itu, konsentrasi zat yang ditotolkan harus tepat untuk menghasilkan noda yang baik, solven/pelarut/eluen murni atau campuran yang akan mengelusi senyawa-senyawa dalam sampel sepanjang fasa diam. Beberapa hal yang harus diperhatikan dalam pemilihan eluen adalah eluen yang terlalu polar akan mengelusi semua senyawa dalam sampel artinya faktor yang menghambat elusi tidak cukup kuat dan kepolaran senyawa-senyawa dalam sampel berpengaruh terhadap pemilihan eluen (berhubungan dengan sifat kepolarannya) dimana bagian dalam bejana harus dijenuhkan terlebih dahulu dengan eluen. Selanjutnya adanya penampak noda, terutama digunakan jika yang dipisahkan bukan senyawa-senyawa yang berwarna.
Beberapa metode yang biasa digunakan adalah.
-
Sinar UV dimana beberapa senyawa akan nampak sebagai noda yang berpendar;
-
Indikator fluoresensi yang sudah terdapat dalam plat lapis tipis yang digunakan (ada tanda GF untuk silika gel) amka plat tersebut akan menjadi berfluoresensi jika diletakkan di bawah lampu UV dan senyawa-senyawa akan muncul sebagai noda gelap;
-
Iod bereaksi dengan sebagian besar senyawa oganik membentuk senyawa kompleks berwarna kuning atau coklat. Noda akan dapat terdeteksi dengan jalan meletakkan plat kering dalam sebuah bejana yang telah berisi kristal iod dan tertutup rapat sehingga bejana jenuh dengan uap iod. Penampak noda ini bersifat umum, dapat digunakan untuk mendeteksi adanya ikatan tunggal. Ikatan rangkap dan aromatis
-
Atomisasi dilakukan dengan meletakkan suatu pereaksi di atas plat yang akan dapat menyebabkan terjadinya reaksi antara senyawa dengan pereaksi tersebut.
Beberapa pereaksi semprot untuk penampak noda (penyemprotan sebaiknya dilakukan di dalam lemari asam karena beberapa pereaksi bersifat toksik), antara lain:
-
Anhidirida asam asetat-asam sulfat pekat (pereaksi Lieberman-Burchard) untuk steroid dan triterpenoid, dimana pembuatan 5 ml anhidrida asam asetat dicampur secara hati- hati dengan 5 ml asam sulfat pekat, kemudian campuran ini ditambahkan juga secara hati-hati ke dalam 50 ml etanol absolut. Setiap pencamputan zat dilakukan dengan pendinginan. Dianjurkan untuk emnggunakan pereaksi yang baru setiap pemakaian. Perlakuan setelah penyemprotan adalah dipanaskan selama 10 menit pada 100°C. adanya terpenoid akan ditandai dengan munculnya warna merah sedangkan warna biru untuk steroid
-
Anisaldehida-asam sulfat untuk gula, steroid dan terpenoid. Dimana pembuatannya adalah dengan menambahkan 1 ml asam sulfat pekat ke dalam 0,5 ml anisaldehida dalam 50 ml asam asetat. Dianjurkan untuk menggunakan pereaksi yang baru setiap pemakaian. Perlakuan setelah penyemprotan adalah dipanaskan pada 100-105°C sampai noda muncul dengan intensitas warna yang maksimum. Latar belakang yang berwarna merah muda dapat dihilangkan dengan membiarkannya terkena uap dari penangas air
-
Aluminium klorida untuk flavonoid. Dibuat dengan melarutkan 1% aluminium klorida ke dalam etanol. Perlakuan setelah penyemprotan adalah dengan menganalisis noda berfluoresensi kekuningan dengan lampu UV
-
Antimonklorida untuk flavonoid. Dibuat dengan melarutkan 10% antimon (III) klorida dalam kloroform. Perlakuan setelah penyemprotan adalah dengan menganalisis noda berfluoresensi kekuningan dengan lampu UV
-
Cerium sulfat-asam sulfat bersifat umum, dapat digunakan untuk semua senyawa organik. Pembuatannya dilakukan dengan mencampurkan cerie sulfat dengan larutan asam sulfat 65%. Perlakuan setelah penyemprotan adalah melakukan pemanasan selama 15 menit pada 120°C. Untuk pereaksi ini tidak dapat diguanakn untuk KLT dengan adsorben alumina
-
Pereaksi dragendorf (menurut Munier) untuk alkaloid (uji positif ditandai dengan munculnya warna coklat kemerahan) dan senyawa lain yang mengandung nitrogen. Pembuatannya larutan a adalah dengan melarutkan 1,7 gram bismut nitrat basa dengan 20 gram asam tartrat yang dilarutkan dalam 80 ml air. Larutan b adalah dengan melarutkan 16 gram kalium iodida ke dalam 40 ml air. Larutan stok adalah dengan mencampur larutan stok a dan b dengan jumlah yang sama kemudian dicampur dan dapat disimpan selama beberapa bulan dalam lemari pendingin. Pereaksi semprot dibuat dengan 5 ml larutan stok ditambahkan ke dalam larutan 10 gram asam tartrat dalam 50 ml air
-
Magnesium asetat untuk antrakuinon. Pembuatannya adalah dengan melarutkan 0,5% magnesium asetat dalam metanol. Kemudian perlakuan setelah penyemprotan adalah dengan memansakannya selama 5 menit pada suhu 90°C. noda berwarna oranye-ungu
-
Potasium hidroksida metanolik untuk kumarin dan antrakuinon. Pembuatannya adalah dengan melarutkan 5% KOH dalam metanol (pereaksi borntrager). Uji positif ditandai dengan munculnya warna merah. Perlakuan setelah penyemprotan adalah dengan menunggu plat hingga kering dan dianalisis menggunakan sinar UV.
Selain kromatografi lapis tipis, biasanya yang sering digunakan seperti uraian di atas, pada penelitian-penelitian fitokimia juga sering digunakan kromatografi lapis tipis preparatif (KLTP) dan kromatografi lapis tipis centrifugal.
2. Kromatografi Lapis Tipis Preparatif (KLTP)
KLTP merupakan salah satu metode pemisahan yang memerlukan pembiayaan paling murah dan memakai peralatan paling dasar. Walaupun KLTP dapat memisahkan bahan dalam jumlah gram, sebagian besar pemakaian hanya dalam jumlah miligram. Berbagai penelitian telah dilakukan untuk mengetahui pengaruh ketebalan plat yang sering dipakai adalah 0,5-2 mm. ukuran plat biasanya 20 x 20 cm atau 20 x 40 cm. Untuk jumlah sampel 10- 100 mg, dapat dipisahkan menggunakan KLTP dengan adsorben silika gel atau aluminium oksida dengan ukuran 20 x 20 cm dan tebal 1 mm. jika tebalnya diduakalikan, maka banyaknya sampel yang dapat dipisahkan bertambah 50%. Seperti halnya KLT biasa, adsorben yang paling umum pada KLTP adalah silika gel.
Plat KLT dapat dibuat sendiri atau dibeli dengan plat sudah terlapisis adsorben. Keuntungan membuat plat sendiri adalah bahwa ketebalan dan susunan lapisan dapat diatur sesuai kebutuhan (misalnya dengan menambahkan AgNO3 atau buffer). Petunjuk untuk pembuatan plat KLTP biasanya terdapat pada kemasan adsorben yang akan dipakai.
Sebelum ditotolkan pada plat KLTP, sampel dilarutkan terlebih dahulu dalam sedikit pelarut. Pelarut yang baik adalah pelarut yang mudah menguap (n-heksana, diklorometana atau etil asetat) karena jika pelarut yang digunakan tidak mudah menguap, maka akan terjadi pelebaran pita. Konsentrasi sampel juga sebaiknya hanya 5-10%. Sampel yang ditotolkan harus berbentuk pita yang sesempit mungkin karena baik tidaknya pemisahan juga bergantung pada lebarnya pita. Penotolan dapat dilakukan dengan tangan menggunakan pipa kapiler, dapat juga menggunakan alat penotol otomatis. Untuk pita yang terlanjur terbentuk terlalu lebar dapat dilakukan perbaikan dengan mengelusi plat menggunakan eluen/larutan polar sampai kira-kira 2 cm di atas tempat penotolan, dikeringkan, kemudian elusi dilanjutkan dengan menggunakan pelarut yang diinginkan.
Pilihan pelarut ditentukan berdasarkan pemisahan terbaik pada KLT. Jadi, pelarut yang digunakan pada KLT dapat digunakan langsung pada KLTP jika adsorben yang digunakan juga sama. Fase gerak biner yang sering digunakan pada pemisahan menggunakan KLTP adalah n- heksana-etil asetat, n-heksana-aseton dan kloroform-metanol. Keefisienan pemisahan dapat ditingkatkan dengan cara elusi berulang. Jika elusi pertama telah selesai, pelat dikeringkan kemudian dimasukkan lagi ke dalam bejana. Proses elusi ini dapat diulang beberapa kali.
Kebanyakan adsorben KLTP mengandung fluorescen yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Untuk senyawa yang tidak menyerap sinar UV dapat dilakukan dengan menutup plat dengan sepotong kaca dan menyemprot salah satu sisi dengan pereaksi penampak noda dan juga menambahkan senyawa pembanding. Pita yang kedudukannya telah diketahui, dikerok dari plat. Selanjutnya senyawa harus diekstraksi dari adsorben dengan pelarut yang sesuai (5ml pelarut untuk 1 gram adsorben). Diupayakan untuk menggunakan pelarut yang paling nonpolar yang mungkin. Harus diperhatikan bahwa makin lama senyawa kontak dengan adsorben, maka makin besar kemungkinan senyawa tersebut mengalami peruraian. Selanjutnya ekstrak yang diperoleh disaring menggunakan corong berkaca masir atau menggunakan membran.
Plat KLT siap pakai yang dibeli biasanya mengandung zat pengikat dan indikator yang susunan kimianya tidak diketahui. Ketika senyawa yang dipisahkan dengan KLTP diekstraksi, zat pengikat dan indikator serta pencemar lainnya kemungkinan besar akan terekstraksi juga. Makin polar pelarut yang digunakan untuk ekstraksi maka makin banyak zat yang tidak diinginkan yang akan ikut terekstraksi. Di samping itu, pelarut yang terlalu polar akan dapat melarutkan adsorben. Beberapa penelitian yang telah dilakukan menyatakan bahwa pencemar yang sering ikut terekstraksi adalah golongan ftalat dan poliester. Untuk menghilangkan pencemar ini, dianjurkan untuk melakukan pemurnian tahap akhir dengan filtrasi gel menggunakan sephadex LH-20.
KLTP klasik mempunyai beberapa kekurangan. Kekurangan yang utama adalah pengambilan senyawa dari plat yang dilakukan melalui proses ekstraksi dari adsorben. Jika yang dikerok dari plat adalah senyawa beracun, maka dapat timbul masalah. Kekurangan yang lain adalah waktu yang diperlukan dalam proses pemisahan yang cukup panjang, adanya pencemar setelah proses ekstraksi senyawa dari adsorben dan biasanya rendemen yang diperoleh berkurang 40-50% dari bahan awal. Untuk mengatasi beberapa masalah tersebut, beberapa pendekatan yang melibatkan kromatografi sentrifugal dapat dicoba.
3. Kromatografi sentrifugal
Pada prinsipnya kromatografi sentrifugal adalah kromatografi klasik dengan aliran fasa gerak yang dipercepat oleh gaya sentrifugal. Contoh alat kromatografi ini yang sering dipakai adalah kromatotron. Perbedaan besar antara kromatotron dengan KLT sentrifugal lainnya adalah bahwa pada rotornya tidak mendatar tetapi miring. Bagian utama dari alat ini adalah plat kaca bundar bergaris tengah 24 cm yang dilapisi dengan adsorben yang cocok sehingga terbentuk lapisan tipis untuk pemisahan preparatif.
4. Kromatografi kolom
Kromatografi kolom juga merupakan suatu metode pemisahan preparatif. Metode ini memungkinkan untuk melakukan pemisahan suatu sampel yang berupa campuran dengan berat beberapa gram. Kelemahan metode ini adalah diperlukan eluen yang cukup besar, waktu elusi untuk dapat menyelesaikan pemisahan sangat lama, deteksi hasil pemisahan tidak dapat langsung dilakukan (masih memerlukan KLT).
Pada prinsipnya kromatografi kolom adalah suatu teknik pemisahan yang didasarkan pada peristiwa adsorpsi. Sampel yang biasanya berupa larutan pekat diletakkan pada ujung atas kolom. Eluen atau pelarut dialirkan secara kontinu ke dalam kolom. Dengan adanya gravitasi atau karena bantuan tekanan, maka eluen/pelarut akan melewati kolom dan proses pemisahan akan terjadi. Seperti pada umumya, eluen/pelarut akan digunakan dimulai dari yang paling non polar dan dinaikkan secara gradien kepolarannya hingga pemisahan dapat terjadi. Sama halnya pada KLT, pemisahan dapat terjadi karena adanya perbedaan afinitas senyawa pada adsorben dan perbedaan kelarutan senyawa pada eluen/pelarut.
Ketika sampel diletakkan di ujung kolom, seketika itu juga sudah terjadi peristiwa adsorpsi oleh permukaan adsorben yang berbatasan dengan sampel. Eluen yang dialirkan secara kontinu ke dalam kolom akan menyebabkan adanya peristiwa adsorbsi dan desorpsi senyawa-senyawa pada sampel. Molekul-molekul senyawa akan dibawa ke bagian bawah kolom dengan kecepatan yang bervariasi bergantung pada besarnya afinitas molekul tersebut pada adsorben dan juga pada besarnya kelarutan molekul tersebut dalam eluen/pelarut. Cairan yang keluar dari kolom ditampung dan dilakukan analisis menggunakan KLT untuk melihat hasil pemisahannya.
Pada kromatografi kolom, hal-hal yang paling berperan dalam kesuksesan pemisahan adalah pemilihan adsorben dan eluen/pelarut, dimensi kolom yang digunakan serta kecepatan elusi yang dilakukan.
Adsorben yang umum digunakan selain SiO2 dan selulosa adalah alumina, yang tersedia dalam bentuk asam, basa atau netral. Adsorben ini dianjurkan hanya dipakai untuk senyawa-senyawa organik yang stabil. Pemilihan adsorben da bentuknya (asam, basa atau netral) sangat penting untuk menghindari reaksi yang dapat terjadi di dalam kolom yang tidak diinginkan selama proses elusi berlangsung, misalnya alumina asam dapat menimbulkan reaksi dehidrasi alkohol tersier dan bentuk basanya dapat mengakibatkan reaksi hidrolisis ester atau reaksi kondensasi aldol pada aldehida.
Adsorben lain yang umum dipakai adalah silika gel, yang terutama digunakan untuk memisahkan senyawa organik yang tidak memiliki kestabilan yang memadai untuk dipisahkan menggunakan alumina.
Besarnya butir/granul adsorben yang digunakan pada kromatografi kolom harus lebih besar dibandingkan dengan yang digunakan pada KLT, yaitu antara 50-200 µm. dengan ukuran tersebut, pengisian kolom secara homogen dapat terlaksana, kecepatan elusi juga berjalan sebagaimana seharusnya serta pergantian senyawa yang teradsorpsi pada dsorben dan kelarutannya pada eluen/pwlarut terjadi cukup cepat.
Jumlah adsorben yang digunakan bergantung pada tingkat kesulitan pemisahan dan pada jumlah sampel yang akan dipisahkan. Secara umum diperlukan 30-50 gram adsorben untuk tiap gram sampel yang akan dipisahkan. Jumlah tersebut bisa mencapai 200 gram adsorben jika pemisahan yang dilakukan cukup sulit. Dibutuhkan jumlah adsorben yang lebih sedikit untuk memisahkan senyawa-senyawa yang perbedaan polaritasnya sangat besar.
Eluen/pelarut yang digunakan, umumnya adalah campuran dua macam pelarut. Pada awal elusi dimulai dengan eluen yang paling nonpolar yang akan membawa senyawa- senyawa yang kurang terikat pada adsorben (yang paling nonpolar). Sepanjang proses elusi, komposisi eluen dapat divariasi dengan jalan menambahkan secara gradien pelarut yang lebih polar. Dengan demikian, senyawa-senyawa juga hanya akan terelusi ke arah bawah kolom secara berurutan berdasarkan kepolarannya. Adalah komposisi yang pertama dari eluen yang memiliki kemampuan elusi terkuat. Oleh karena itu sepanjang elusi proporsi pelarut yang lebih polar dinaikkan dengan jalan menambahkan pelarut yang lebih polar ke dalam pelarut yang kurang polar secara eksponensial.
Penggunaan beberapa eluen harus dihindari tatkala yang digunakan sebagai adsorben adalah alumina atau silika gel dalam bentuk asam atau basanya. Pelarut sangat polar seperti metanol, air dan asam asetat juga harus dipergunakan secara hati-hati karena akan melarutkan adsorben dalam jumlah kecil.
Kolom yang digunakan untuk keperluan pemisahan ini, pada bagian bawahnya biasanya dilengkapi dengan plat kaca masir (bisa juga digunakan glas wool atau kapas bebas lemak) baik dalam bentuk fix ataupun mobile yang berguna untuk melewatkan eluen secara bebas tetapi yang juga dapat menghambat keluarnya adsorben dari kolom. Buret dapat juga digunakan untuk keperluan ini, dengan menambahkan kaca masir atau glass wool di bagian bawah buret. Jumlah adsorben yang dimasukkan ke dalam kolom sedemikian rupa sehingga memenuhi tinggi kolom 10 kali diameter kolom, biasanya juga disisakan ruang kosong di atas adsorben tersebut kira-kira 10 cm untuk sampel dan pelarut.
Kecepatan elusi sebaiknya dibuat konstan. Kecepatan tersebut harus cukup lambat sehingga senyawa berada dalam keseimbangan antara fasa diam dan fasa gerak, sebaliknya jika kecepatan elusi ini terlalu kecil, maka senyawa-senyawa akan terdifusi ke dalam eluen dan akan menyebabkan pita makin lama makin lebar yang akibatnya pemisahan tidak dapat berlangsung dengan baik. Kecepatan elusi yang besar dapat dilakukan jika yang akan dipisahkan adalah campuran senyawa yang memiliki kepolaran yang sangat berbeda.
Sebelum melakukan pemisahan menggunakan kromatografi kolom, sangat dianjurkan untuk mencobanya terlebih dahulu dengan KLT. Hal ini dilakukan untuk mengetahui kompleksitas campuran yang akan dipisahkan dan sekaligus untuk menemukan sistem eluen yang akan digunakan untuk proses pemisahan menggunakan kromatografi kolom. Beberapa hal yang perlu diperhatikan adalah mencari campuran dua pelarut dengan perbedaan polaritas cukup besar yang paling mungkin (misal: petroleum eter dengan diklorometana) dan Rf sebagian besar senyawa sebaiknya lebih rendah dari 0,4. Dari beberapa pengamatan diketahui bahwa semakin kecil harga Rf suatu senyawa, maka makin besar jumlah eluen yang diperlukan untuk mengelusi senyawa tersebut dari kolom. Dengan demikian, senyawa- senyawa yang memiliki harga Rf 0,8 dan 0,9 akan sulit untuk dipisahkan karena keduanya akan terelusi oleh eluen hanya dalam jumlah kecil sehingga tidak ada waktu untuk terpisah.
Tahap yang paling sulit dalam kromatografi kolom adalah pengisian kolom dengan adsorben. Pengisian tersebut harus sehomogen mungkin dan harus benar-benar bebas dari gelembung udara. Permukaan adsorben juga harus benar-benar horisontal untuk menghindari terjadinya cacat yang dapat terjadi selama proses elusi berjalan. Untuk itu yang pertama harus diperhatikan adalah menempatkan kolom pada posisi yang benar-benar vertikal.
Sumber :
Lully Hanni Endarini, Farmakognisi dan Fitokimia, Badan Pengembangan dan Pemberdayaan Sumber Daya Manusia Kesehatan