Keratin
Pada bagian ini dijelaskan dua protein fibrous yang umum yaitu keratin dan collagen. Keratin adalah protein yang tahan secara mekanik dan tidak bereaksi secara kimia. Protein ini terdapat pada semua vertebrata tingkat tinggi. Keratin diklasifikasikan sebagai α-keratin atau β-keratin. Protein α-keratin menyusun hampir seluruh dari rambut, sutera wol, kuku cakar, kulit, bulu domba, bulu ayam, tanduk. Struktur tersier protein α-keratin hampir sama seperti α-helix berbeda hanya pada jarak putaran. Protein α-keratin mempunyai sejumlah besar residu alanin dan leusin. Karena asam amino ini nonpolar dan mengarah ke arah luar dari α-helix akibatnya protein ini sangat tidak larut di dalam air. Protein α-keratin juga mempunyai sejumlah residu cysteine, akibatnya terbentuk ikatan disulfida antara pilinan yang berdekatan. Cakar, tanduk, kuku jari mempunyai ikatan disulfida yang ekstensif sehingga membuatnya sangat keras. Jumlah ikatan disulfida menentukan kekuatan dari material. Protein α-keratin yang paling liat dan keras adalah α-keratin pada kulit kura-kura yang mengandung sistein dalam jumlah tinggi sampai 18%. Dengan demikian, α-keratin dari sumber berbeda akan berbeda pula kandungan sisteinnya.
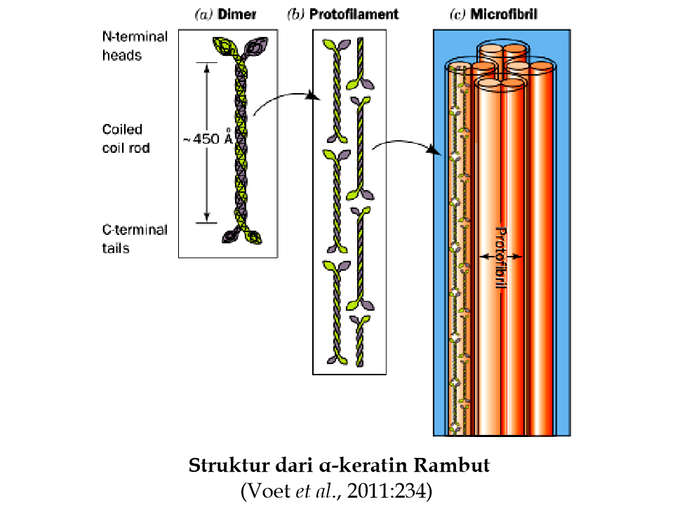
Protein α-keratin yang dijelaskan pada buku ini adalah αkeratin pada rambut. Studi mikroskopik elektron menunjukkan bahwa rambut tersusun terutama dari α-keratin yang terdiri dari susunan bertingkat. Sehelai rambut mempunyai diameter sekitar 20µm yang setiap helainya mengandung paket macrofibril dengan diameter sekitar 2000Aº yang diorientasi paralel. Macrofibril dibangun dari microfibril yang diameternya sekitar 80Aº. Microfibril dibangun oleh protofibril. Pada protofibril terdapat protofilamen.
Pola difraksi sinar–X α-keratin mirip dengan α-helix (oleh sebab itu dinamakan α-keratin). Setiap putaran pada α keratin adalah 5.1-A, sedangkan pada α-helix, 5.4-A. Bukti fisika dan kimia mengusulkan bahwa polipeptida α-keratin membentuk gabungan pasangan yang setiap pasangan disusun dari keratin Tipe I dan Type II yang berputar secara paralel membentuk coil putar-kiri. Rakitan ini dinamakan struktur dimer coiled coil karena saling berpilin pada sumbu helix (Gambar 104a). Dua α-keratin saling berpilin sesamanya membentuk struktur dimer yang dinamakan supercoil atau superhelix. Dimer ini bertinteraksi membentuk struktur protofilamen. Profilamen membentuk protofibril seperti gambar b dan c.
Sutera dan jaring laba-laba merupakan protein fibrous yang juga tidak larut di dalam air. Protein ini fleksibel dan lentur, tetapi protein ini tidak dapat diregang. Protein sutera dan jaring laba-laba merupakan protein β-keratin. Protein β-keratin berbeda dari αkeratin. Protein α-keratin rambut dapat diregang sampai hampir dua kali jika rambut diberikan uap panas. Dalam keadaan regang ini pola difraksi sinar-X rambut menyerupai serat sutera. Pengamatan ini menyimpulkan bahwa jika α-keratin rambut diregang konformasi α-helix rusak. Struktur sekunder protein pada β-keratin adalah β-sheet. Struktur ini hanya bisa terbentuk jika gugus R residu asam amino berukuran relatif kecil seperti glisin dan alanin.
Collagen
Kata collagen berasal dari bahasa Yunani: ‘kolla’ artinya lem. Collagen adalah komponen protein utama jaringan penghubung dari vertebrata dan merupakan protein paling melimpah. Collagen terdiri dari sekitar 30% dari total protein mamalia. Collagen merupakan protein ekstraseluler yang diorganisasi masuk ke jaringan. Collagen cocok perannya sebagai komponen utama jaringan pengikat seperti pada tulang, gigi, tulang rawan, urat, matrik organik dari tulang dan kornea mata. Jaringan pengikat juga menyelubungi pembuluh darah, membentuk dan mengikat sel bersama-sama menjadi jaringan. Urat sebagian besar tersusun atas collagen.
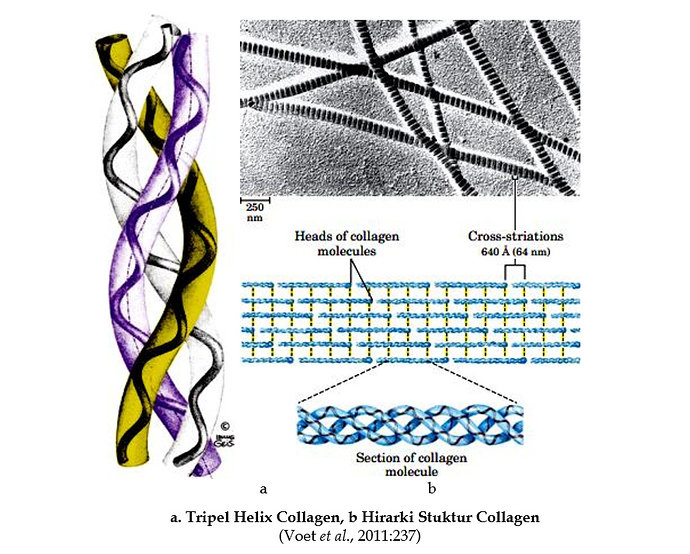
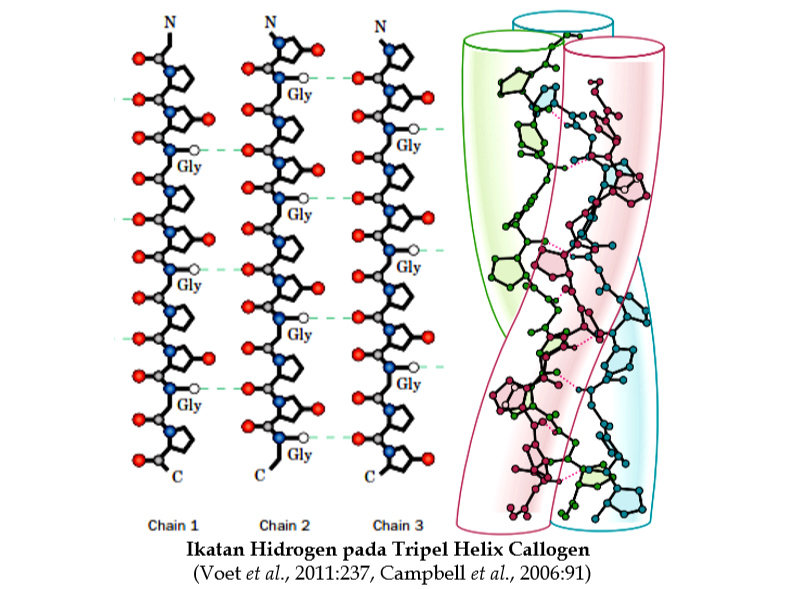
Struktur collagen ditemukan oleh GN.Ramachandran. Molekul collagen merupakan tripel helix yaitu tiga untai putar kiri satu sama lain membentuk supercoiled. Tripel helix collagen distabilkan oleh ikatan hidrogen antar rantai. Setiap helix putar-kiri mempunyai tiga residu asam amino per putaran dengan jarak 0,31 nm setiap residu asam amino. Sebagai akibatnya, helix collagen lebih panjang dari pada sebuah α-helix .
Helix collagen adalah struktur sekunder yang unik dibandingkan α-helix. Tidak seperti α-helix, helix pada collagen tidak mempunyai ikatan hidrogen dalam rantai. Tripel helix collagen mempunyai kekuatan tarik yang lebih besar dibandingkan kawat baja pada ukuran penampang yang sama.
Sekuens residu asam amino protein ini pada daerah putaran terdiri dari pengulangan –Gly-X-Y- dimana X sering prolin dan Y sering prolin termodifikasi yang dinamakan 4-hydroxyprolin. Residu hydroxyprolin dibentuk ketika prolin spesifik dihidroksilasi setelah pemasukan ke rantai polipeptida collagen. Reaksi hydroxilasi dikatalis oleh enzim dan membutuhkan vitamin C. Hidroksilasi tidak terbentuk dalam ketiadaan vitamin C dan tripel helix collagen tidak dapat dirakit dengan tepat. Residu prolin dan 4Hydroxyprolin memungkinkan putaran tajam dari helix collagen. Untuk setiap triplet –Gly-X-Y-, satu ikatan hidrogen terbentuk antara hidrogen amida dari glisin dalam satu rantai dan atom oksigen karbonil dari residu X pada rantai yang berdekatan. Gelatin berasal dari collagen.