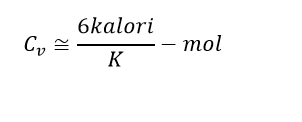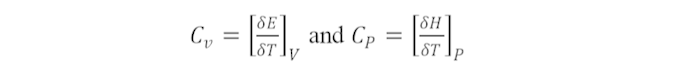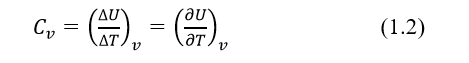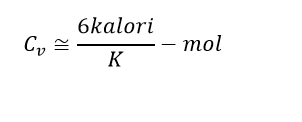Dalam padatan, terdapat dua jenis energi termal yang tersimpan di dalammya yaitu energi vibrasi atom-atom di sekitar posisi keseimbangannya dan energi kinetik yang dikandung bebas elektron. Jika suatu padatan menyerap panas maka energi internal yang tersimpan dalam padatan meningkat yang diindikasikan oleh kenaikan temperaturnya. Jadi perubahan energi pada atom-atom dan elektron-bebas menentukan sifat-sifat termal padatan. Sifat-sifat termal yang akan kita bahas adalah kapasitas panas.
Tiap-tiap atom pada benda padat ini dapat berosilasi ke tiga arah dengan bebas, sehingga padatan dapat dilihat sebagai sistem yang memiliki 3N osilator harmonik sederhana, dengan N menentukan jumlah atom untuk kekisi kristal tersebut. Oleh karena setiap osilator harmonik memiliki energi rata-rata kBT, energi total rata-rata padatan sebesar 3NkBT, dan kapasitas kalornya adalah 3NkB.
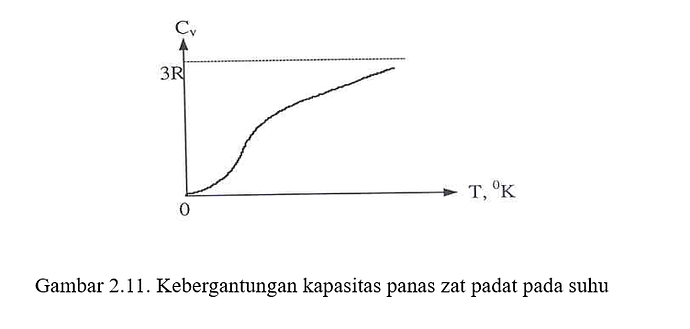
Dengan mengambil nilai N sebagai tetapan Avogadro NA, dan menggunakan hubungan R = NAkB antara gas tetapan R dengan tetapan Boltzmann kB, hal ini akan menjelaskan hukum Dulong-Petit tentang sumber daya kalor jenis bahan yang dipadatkan, yang dilaporkan sebagai jenis kalor jenis (per volume massa) suatu benda padat berbanding terbalik terhadap bobot atomnya. Dalam versi modernya, kapasitas kalor molar suatu benda padat adalah 3R ≈ 6 kal / (mol • K).
Namun, hukum ini menjadi tidak akurat pada temperatur yang rendah. Hal ini disebabkan oleh efek-efek kuantum. Selain itu, hukum ini juga tidak sesuai dengan hukum termodinamika, yang sesuai dengan kapasitas kalor molar zat apa pun haruslah menuju nilai nol sesuai dengan sistem suhu menuju nol. Teori yang lebih akurat kemudian dikembangkan oleh Albert Einstein (1907) dan Peter Debye (1911) dengan memasukkan pertimbangan efek-efek kuantum.
Kapasitas Panas adalah jumlah panas (∆Q) yang dibutuhkan per mol zat untuk membeli suhunya 1 K, disebut kapasitas kalor. Untuk menentukan dengan kapasitas panas yang ditulis dengan huruf besar (Cv dan Cp), maka panas spesifik dituliskan dengan huruf kecil (cv dan cp). Bila Peningkatan suhu zat ∆T, maka kapasitas panas adalah:

Jika proses perpindahan panas berlanjut pada volume tetap, maka panas yang diserap sama dengan Peningkatan energi dalam zat ∆Q = ∆U. Volume tetap pada volume tetap (Cv) dapat dinyatakan:
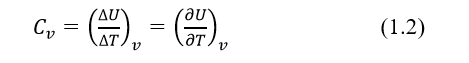
Dengan U adalah energi internal padatan adalah energi total yang ada dalam padatan baik dalam bentuk vibrasi atom maupun energi kinetik elektron bebas.
Kapasitas panas pada tekanan konstan, (Cp) dengan relasi

dengan H adalah enthalpi. Pengertian enthalpi dimunculkan dalam termodinamika karena sungguh sangat sulit menambah energi pada padatan (hanya meningkatkan kandungan energi internal) saja dengan meningkatkan tekanan konstan. Jika kita memasukkan energi panas ke atas logam, sebenarnya energi yang kita miliki tidak hanya meningkatkan energi internal yang diperlukan untuk melakukan kerja pada saat pemuaian terjadi. Pemuaian adalah volume perubahan, dan pada saat volume berubah dibutuhkan energi sebesar volume perubahan udara luar dan energi yang dibutuhkan diambil dari energi yang kita masukkan. Oleh karena itu didefinisikan analisis sederhana, yaitu
H = U + PV (1.4)
dengan P adalah tekanan dan V adalah volume.
Kapasitas panas zat pada suhu tinggi mendekati nilai 3R; R menyatakan tetapan gas umum. Karena R ≅ 2 kalori/K-mol, maka pada suhu tinggi kapasitas panas zat padat :