
Proses matangnya telur merupakan salah satu fenomena denaturasi protein. Apa yang dimaksud dengan Denaturasi Protein?

Proses matangnya telur merupakan salah satu fenomena denaturasi protein. Apa yang dimaksud dengan Denaturasi Protein?
Denaturasi protein adalah fenomena transformasi struktur protein yang berlipat menjadi terbuka. Perubahan konformasi protein mempengaruhi sifat protein (Estiasih, 2016).
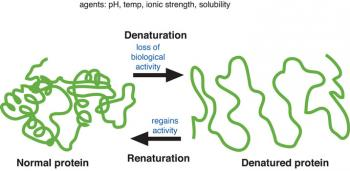
Selama denaturasi, ikatan hidrogen dan ikatan hidrofobik dipecah, sehingga terjadi peningkatan entropi atau peningkatan kerusakan molekulnya. Denaturasi mungkin dapat bersifat bolak-balik (reversibel), seperti pada kimotripsin yang hilang aktivitasnya bila dipanaskan, tetapi aktivitasnya akan pulih kembali bila didinginkan. Namun demikian, umumnya tidak mungkin memulihkan protein kembali ke bentuk aslinya setelah mengalami denaturasi. Kelarutan protein berkurang dan aktivitas biologisnya juga hilang pada saat denaturasi. Aktivitas biologis protein di antaranya adalah sifat hormonal, kemampuan mengikat antigen, serta aktivitas enzimatik.
Protein-protein yang terdenaturasi cenderung untuk membentuk agregat dan endapan yang disebut koagulasi. Tingkat kepekaan suatu protein terhadap pereaksi denaturasi tidak sama, sehingga sifat tersebut dapat digunakan untuk memisahkan protein yang tidak diinginkan dari suatu campuran dengan cara koagulasi (Bintang, 2010). Denaturasi disebabkan oleh beberapa faktor antara lain :
1. Penyebab Fisik
Panas
Ketika larutan protein dipanaskan secara bertahap di atas suhu kritis, protein mengalami transisi dari keadaan asli ke terdenaturasi. Mekanisme suhu menginduksi denaturasi protein cukup kompleks dan menyebabkan destabilisasi interaksi nonkovalen di dalam protein. Ikatan hidrogen, interaksi elektrostatik, dan gaya van der Waals bersifat eksotermis, sehingga mengalami destabilisasi pada suhu tinggi dan mengalami stabilisasi pada suhu rendah. Sebaliknya, interaksi hidrofobik bersifat endotermis, sehingga mengalami destabilisasi pada suhu rendah dan mengalami stabilisasi pada suhu tinggi.
Ikatan hidrogen antar ikatan peptida kebanyakan terkubur di bagian dalam struktur protein, sehingga tetap stabil pada berbagai kisaran suhu. Akan tetapi, stabilitas interaksi hidrofobik tidak dapat meningkat secara tajam dengan meningkatnya suhu. Hal tersebut disebabkan setelah melewati suhu tertentu, struktur air secara bertahap pecah dan menyebabkan denaturasi interaksi hidrofobik.
Tekanan
Denaturasi akibat tekanan terjadi pada suhu 25⁰C jika tekanan yang diberikan cukup tinggi. Kebanyakan protein mengalami denaturasi pada tekanan 1-12 kbar. Tekanan dapat menyebabkan denaturasi protein karena protein bersifat fleksibel dan dapat dikompresi. Walaupun residu asam amino tersusun rapat di bagian dalam protein globular, biasanya masih terdapat rongga di dalam protein. Akibatnya, protein bersifat dapat dikompresi dan terjadi penurunan volume protein. Penurunan volume tersebut disebabkan rongga yang hilang dalam struktur protein dan hidrasi protein. Denaturasi akibat tekanan bersifat reversibel.
Pengadukan
Pengadukan mekanik kecepatan tinggi seperti pengocokan, pengulenan, dan pembuihan menyebabkan protein terdenaturasi. Banyak protein yang terdenaturasi dan mengalami presipitasi ketidak diaduk intensif. Denaturasi terjadi akibat inkorporasi udara dan adsorpsi molekul protein ke dalam antarmuka udara-cairan. Energi untuk antarmuka udara-cairan lebih besar dibandingkan fase curah sehingga protein mengalami perubahan konformasi dipengaruhi oleh fleksibilitas protein. Protein dengan fleksibilitas tinggi lebih cepat berada pada antarmuka udara-cairan, sehingga terdenaturasi lebih cepat dibandingkan protein yang kaku (rigid). Ketika pengadukan tinggi dilakukan menggunakan pengaduk berputar maka akan terbentuk kavitasi. Keadaan ini menyebabkan protein mudah terdenaturasi. Pengadukan yang lebih cepat menyebabkan tingkat denaturasi yang lebih tinggi.
2. Penyebab Kimiawi
pH atau tingkat keasaman
Protein bersifat lebih stabil pada pH di titik isolelektrik dibandingkan pH lain. Pada pH netral, kebanyakan protein bermuatan negatif dan hanya sedikit yang bermuatan positif. Rendahnya gaya tolak elektrostatik dibandingkan interaksi yang lain, menjadikan kebanyakan protein bersifat stabil pada pH mendekati netral. Pada pH ekstrem, gaya tolak elektrostatik dalam molekul protein yang disebabkan muatan tinggi mengakibatkan struktur protein membengkak dan terbuka. Derajat terbukanya struktur protein lebih besar pada pH alkali dibandingkan pada pH asam.
Pada kondisi alkali terjadi ionisasi gugus karboksil, fenolik, dan sulfihidril di bagian dalam protein sehingga struktur protein terbuka dengan tujuan mengekspos gugus tersebut pada fase air. Denaturasi protein akibat pH kebanyakan bersifat reversibel. Akan tetapi, pada sejumlah kasus hidrolisis ikatan peptida secara parsial, deamiadase residu asparagin dan glutamin, dan kerusakan gugus sulfihidril pada pH alkali dapat menyebabkan denaturasi protein yang bersifat irreversibel.
Pelarut Organik
Pelarut organik mempengaruhi stabilitas interaksi hidrofobik protein, ikatan hidrogen, dan interaksi elektrostatik. Rantai samping residu asam amino nonpolar lebih larut pada pelarut organik dibandingkan air. Hal tersebut mengakibatkan interaksi hidrofobik menjadi melemah. Sebaliknya, stabilitas dan pembentukan ikatan hidrogen antarikatan peptida meningkat pada lingkungan dengan permisivitas rendah maka sejumlah pelarut organik dapat meningkatkan atau memperkuat pembentukan ikatan hidrogen antarikatan peptida. Pada konsentrasi rendah, sejumlah pelarut organik dapat menstabilkan beberapa enzim terhadap denaturasi. Pada konsentrasi tinggi, pelarut organik menyebabkan protein terdenaturasi karena efek pelarutan rantai samping nonpolar.
Senyawa Organik
Sejumlah senyawa organik seperti urea dan guanidin hidroksida menyebabkan denaturasi protein. Urea dan guanidin pada konsentrasi tinggi membentuk ikatan hidrogen dan menyebabkan ikatan hidrogen dalam air menjadi terganggu. Rusaknya ikatan hidrogen antarmolekul air menjadikan air sebagai pelarut yang baik untuk residu nonpolar. Dampaknya adalah struktur protein terbuka dan terjadi pelarutan residu nonpolar dari bagian dalam molekul protein.
Deterjen
Deterjen seperti Sodium Dodecyl Sulfate (SDS) merupakan pendenaturasi protein yang kuat. Deterjen terikat kuat pada protein yang terdenaturasi sehingga menyempurnakan denaturasi. Akibatnya, denaturasi protein menjadi bersifat irreversibel.
Garam
Garam mempengaruhi stabilitas struktural protein. Hal ini berkaitan dengan kemampuan garam untuk mengikat air secara kuat dan mengubah sifat hidrasi protein. Pada konsentrasi rendah, garam menstabilkan struktur protein karena meningkatkan hidrasi protein dan terikat lemah pada protein. Sebaliknya, garam juga dapat menyebabkan ketidakstabilan struktur protein karena menurunkan hidrasi protein dan berikatan kuat dengan protein.
Pengaruh garam untuk stabilisasi atau destabilisasi struktur protein berkaitan dengan konsentrasi dan pengaruhnya terhadap ikatan air-air. Peningkatan stabilitas protein pada kadar garam rendah disebabkan peningkatan ikatan hidrogen antarmolekul air. Sebaliknya, pada konsentrasi tinggi, garam mendenaturasi protein karena merusak struktur air sehingga air menjadi pelarut yang baik untuk residu nonpolar protein (Estiasih, 2016).
Stuktur tiga dimensi protein merupakan hal yang sangat esensial untuk fungsi protein Kehidupan berada pada range pH dan suhu yang sempit. Bagaimana dua konsep ini dihubungkan dengan struktur protein? Suhu dan pH yang ekstrim mempunyai efek yang besar pada konformasi protein yaitu menyebabkan molekul protein kehilangan karakteristik bentuk tiga dimensinya. Perubahan ini menyebabkan fungsi protein menurun atau hilang sama sekali. Denaturasi terjadi ketika organisasi struktur protein globular seperti α-helix, β-sheet dan pelipatan tersier protein menjadi kacau sempurna. Bagaimanapun juga, denaturasi tidak mengubah struktur primer protein. Denaturasi, dan koagulasi protein dapat terjadi karena pengaruh suhu, pH, pelarut organik, detergen, logam berat dan tekanan mekanik seperti yang sudah dijelaskan di jawaban sebelumnya. Namun disini saya ingin menambahkan beberapa hal yang belum dijelaskan.
Suhu
Pengaruh suhu pada struktur tiga dimensi protein dapat digambarkan sebagai berikut. Kenaikan suhu secara sederhana menaikan kecepatan pergerakan molekul. Jika suhu terus dinaikkan, ikatan di dalam molekul protein mulai bervibrasi. Interaksi lemah seperti ikatan hidrogen, interaksi hidrofobik yang memelihara struktur protein rusak. Dengan kata lain, protein terdenaturasi. Molekul protein yang terdenaturasi akan kehilangan karakteristik konformasi tiga dimensinya. Koagulasi terjadi ketika molekul protein tidak melipat dan menjadi terjerat. Pada keadaan ini protein tidak dapat larut, protein menggumpal dan menjadi padat. Hal ini dapat kita amati efek kenaikan suhu pada putih telur. Putih telur merupakan larutan viscous dari albumin telur. Ketika putih telur dimasak, protein mengalami denaturasi dan selanjutnya terjadi koagulasi dan kita melihatnya sebagai padatan. Banyak protein pada sel kita. Sebagai contoh enzim, enzim dalam sitoplasma sebagai larutan kental (viscous). Untuk menjalankan fungsinya, enzim harus selalu dalam larutan dan terpelihara struktur tiga dimensinya dengan benar. Jika suhu tubuh kita menjadi sangat tinggi, atau jika daerah tertentu dari badan kita sangat tinggi suhunya seperti ketika kita menyentuh pemanggang kue yang panas maka protein seluler menjadi terdenaturasi. Protein kehilangan fungsinya yang dapat mengakibatkan sel atau organisme menjadi mati.
pH
Semua protein mempunyai karakteristik muatan listrik karena gugus R dari asam aminonya. Masing-masing protein mempunyai karakteristik muatan listrik total pada permukaannya karena setiap protein mempunyai komposisi residu asam amino yang berbeda. Gugus R bermuatan positif dan negatif pada permukaan molekul protein berinteaksi dengan ion dan molekul air. Interaksi ini memelihara protein dalam larutan di sitoplasma.
Protein yang diperlihatkan pada gambar a di atas mempunyai muatan total 2+ karena protein tersebut mempunyai dua ekstra gugus NH3+. Jika kita menambahkan dua mol basa seperti NaOH pada protein tersebut, maka gugus amino terprotonasi kehilangkan protonnya yang mengakibatkan muatan protein menjadi netral. Dengan kata lain, muatan total protein menjadi nol. pH dimana protein mempunyai jumlah muatan positip dan muatan negatif sama (muatan totalnya adalah nol) dinamakan titik isoelektrik. Sebaliknya, protein pada gambar b mempunyai muatan total 2- karena terdapat dua ekstra gugus karboksil. Ketika dua mol asam ditambahkan, gugus karboksil menjadi terprotonasi. Sebagai akibatnya protein ‘netral’ dan muatan total protein menjadi nol. Hal ini dapat dikatakan bahwa larutan protein berada pada titik isoelektrik.
Ketika pH larutan protein di atas titik isoelektriknya, maka semua molekul protein akan mempunyai muatan permukaan total negatif. Sebaliknya, ketika pH larutan protein di bawah titik isoelektrik protein akan mempunyai muatan total positip. Pada titik isoelektrik molekul protein tidak mempunyai muatan total permukaan. Sebagai akibatnya, protein tidak kuat menolak satu sama lainnya dan protein paling sedikit larut.
Pengaruh pH dapat kita amati pada susu yang diletakkan di kulkas untuk waktu yang lama. Bakteri pada susu mulai tumbuh. Bakteri menggunakan gula susu (laktosa) sebagai sumber energi dalam proses fermentasi dan menghasilkan asam laktat sebagai produknya. Bakteri berlanjut tumbuh dan berkembang yang mengakibatkan konsentrasi asam laktat naik. Kenaikan konsentrasi asam laktat mengakibatkan protonasi dari gugus karboksilat pada permukaan protein susu. Protein menjadi isoelektrik dan mengkoagulasi selanjutnya menjadi padat seperti ‘dadih’.
Pelarut Organik
Pelarut organik polar seperti 2-propanol, dapat mendenaturasi protein dengan merusak ikatan hidrogen di dalam protein. Daerah nonpolar dari pelarut mengganggu interaksi hidrofobik di dalam interior molekul protein dengan demikian mengganggu konformasi protein. Oleh sebab itu, larutan alkohol 70% sering digunakan sebagai antiseptik atau disinfektan. Selain itu, ikatan hidrogen terbentuk antara pelarut dan air.
Detergen
Detergen mempunyai daerah hidrofob dan polar atau daerah hidrofilik. Ketika detergen berinteraksi dengan protein, detergen merusak interaksi hidrofobik menyebabkan rantai protein tidak melipat.
Logam Berat
Logam berat seperti merkuri (Hg2+) dan timbal (Pb2+) mungkin membentuk ikatan dengan gugus rantai samping bermuatan negatif. Hal ini mengganggu jembatan garam yang terbentuk antara gugus R residu asam amino dari rantai protein yang mengakibatkan protein dapat kehilangan konformasi. Logam berat mungkin juga berikatan dengan gugus sulfuhidril dari protein. Hal ini mungkin menyebabkan perubahan besar pada struktur tiga dimensi protein yang mengakibatkan protein dapat kehilangan fungsinya.
Gerakan Mekanik
Pengocokan, pukulan, goncangan dapat merusak interaksi lemah yang memelihara konformasi protein. Pengocokan putih telur menghasilkan busa yang kaku.