
Terdapat beberapa macam gangguan metablisme pada pasien penyakit kronik seperti CKD. Apa Saja Gangguan Metabolisme pada CKD?

Terdapat beberapa macam gangguan metablisme pada pasien penyakit kronik seperti CKD. Apa Saja Gangguan Metabolisme pada CKD?
Pasien dengan penyakit kronik, seperti CKD, mengalami suatu fase yang disebut ‘ anorexia-cachexia ’ syndrome (ACS). ACS merupakan kumpulan gejala yang ditandai dengan penurunan nafsu makan ( anorexia ) dan peningkatan resting energi expenditure (REE) disertai dengan peningkatan pemecahan protein dan kehilangan secara progresif LBM dan otot skeletal. Hal ini didorong oleh adanya pro-inflamatory cytokines dan efeknya secara periperal pada jalur otot skeletal yang mengatur turnover protein dan secara sentral pada neuron-neuron di hipotalamus yang mengatur nafsu makan. ACS menyebabkan keseimbangan energi negatif pada pasien CKD. Meskipun mekanisme ACS masih belum diketahui dengan lengkap, namun cytokines ( e.g . IL-1β, IL-6, dan TNF) berperan dalam perkembangan ACS; sehingga level/aktivitas leptin dan ghrellin kemungkinan terganggu. Leptin adalah anoxigenic peptide yang menurunkan nafsu makan, sedangkan ghrellin adalah orexigenic peptide yang menaikkan nafsu makan. Keduanya merupakan jalur pengaturan nafsu makan di otak/hipotalamus. Pada jalur normal, neuron-neuron pada pusat hipotalamus memproduksi melanocortins ( proopiomelanocortin (POMC)/ cocaine dan amphetamine-regulated transcript (CART)) yang diaktivasi oleh leptin , yang memiliki efek anorextic dan katabolik. Sedangkan neuropeptide Y (NPY) dan angouti-related protein (AgRP) mengekspresikan neuron-neuron yang diaktivasi oleh ghrellin yang memiliki efek orexigenic . Pada pasien CKD, terjadi gangguan pada sirkulasi leptin dan ghrellin , dimana aktivitas POMC/CART tetap sedangkan NPY/AgRP turun. Hal ini berdampak pada meningkatnya REE dan menurunnya nafsu makan.
Adanya inflamasi dan ACS biasa dijumpai pada pasien dengan CKD, terutama pada stage 5. Peningkatan REE tidak dipengaruhi oleh derajat fungsi ginjal, namun kemungkinan lebih dipengaruhi oleh adanya stress inflamasi.
Ginjal berperan dalam menjaga keseimbangan protein tubuh melalui fungsi sintesis, degradasi, filtrasi, reabsorbsi dan ekresi asam amino di tubulus ginjal. Gangguan fungsi ginjal dapat mengakibatkan gangguan berbagai peran ginjal dalam metabolisme protein. Gangguan metabolisme protein yang sering menyertai pasien ginjal lebih dikenal sebagai malnutrisi uremia. Malnutrisi uremia merupakan istilah untuk menggambarkan malnutrisi dan gangguan metabolisme terkait dengan gangguan ginjal. Malnutrisi uremia terjadi pada 20-50% pasien CKD dengan dialisis. Karakteristik malnutrisi uremia meliputi hilangnya cadangan protein tubuh ditandai dengan penurunan massa lemak bebas serta penurunan protein viseral seperti albumin, pre-albumin, dan transferin (Tabel 2). Malnutrisi uremia meningkatkan risiko rawat inap dan kematian, khususnya pada pasien CKD stage 5.
Penyebab malnutrisi uremia antara lain kurangnya asupan zat gizi serta gangguan metabolik dan hormonal (Gambar 3). Anoreksia yang terjadi pada pasien dengan CKD mengakibatkan asupan zat gizi kurang dan berdampak pada menurunnya status gizi. Meskipun mekanisme uremia menyebabkan anoreksia belum jelas, suatu studi oleh Berg-strom et al . menjelaskan isolasi a low molecular weight substance (<5 kd), yang diisolasi dari ultrafiltrat plasma uremic dan urin normal, yang diinjeksikan pada tikus yang sehat, menyebabkan suatu dose-dependent suppression pada nafsu makan. Dengan kata lain, penelitian ini menyimpulkan bahwa uremia menyebabkan nafsu makan berkurang. Disisi lain, diet rendah protein yang dijalani oleh pasien CKD, khususnya gagal ginjal kronik, menyebabkan ketoasidosis .

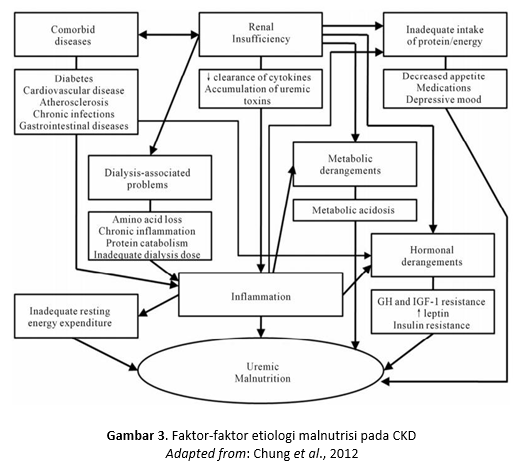
Asidosis metabolik yang menyertai progresivitas CKD, juga menyebabkan malnutrisi uremia melalui meningkatnya katabolisme protein. Studi oleh Mitch et al ., menunjukkan proteolisis otot distimulasi melalui jalur adenosine triphosphate-dependent yang melibatkan ubiquitin ( a single-chain polipeptide ) dan proteosomes selama asidosis metabolik. Berbagai mekanisme yang mempengaruhi turnover protein otot pada pasien CKD dijelaskan pada Gambar dibawah ini .
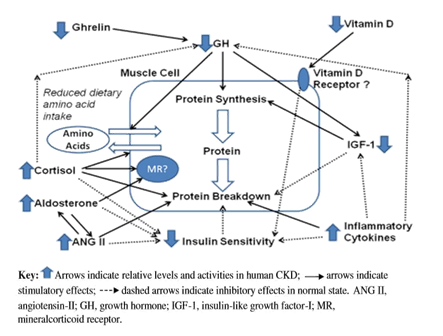
Keterangan:
CKD menyebabkan berbagai gangguan yang mempengaruhi metabolisme otot dan turnover protein. Pertama-tama, CKD dan uremia menyebabkan penurunan nafsu makan/anoreksia melalui berbagai mekanisme, seperti berkurngnya ghrellin yang aktif. Diet rendah protein yang diberikan, menurunkan asupan protein dan pool asam amino di otot. Penurunan asupan protein dan asam amino, mempengaruhi secara langsung jalur sintesis protein di otot (dan menekan pemecahan protein, e.g . asam amino rantai cabang atau branched-chain amino acid /BCAA), secara tidak langsung pada insulin dan growth hormon-insulin-like growth factor -1 (GH-IGF-1). GH-IGF-1 memiliki efek kuat pada transport asam amino, sintesis protein dan mennkan pemecahan protein (melalui IGF-1). Resistensi insulin merupakan problem yang umum pada pasien CKD dan pasien lain dengan proinflammatory response . Hal ini berdampak pada metabolisme secara umum dan efek lokal pada otot dengan penurunan transport zat gizi (glukosa dan asam amino)/kemampuan reaksi sel dan penurunan rata-rata sintesis protein (efek pada pemecahan dan sintesis). Angiotensin II, cortisol dan aldosteron, kemungkinan semua menurunkan sensitivitas insulin. Mediator lain yang mungkin terlibat pada pasien dengan CKD dan fungsi otot, seperti angiotensin II, aldosteron, vitamin D (dan reseptor vitamin D). Glukokortikoid yang mungkin meningkat jumlah maupun aktivitasnya pada CKD memiliki dampak pada otot, yaitu memperkuat resistensi insulin dan meningkatkan pemecahan protein. Adanya proinflammatory cytokines kemungkinan juga mempengaruhi turnover protein otot pada penderita CKD. Dampaknya adalah kehilangan protein, penurunan status gizi dan muscle wasting . Menurunnya status gizi berhubungan dengan meningkatnya morbiditas dan mortalitas pada penderita CKD.
Pada pasien pre-dialisis, protein dari diet diberikan rendah untuk melindungi ginjal melawan hiperfiltrasi dan progresivitas CKD. Diet sangat rendah protein tidak dianjurkan karena dapat memicu keseimbangan nitrogen negatif. Protein yang aman, minimal diberikan 0.6 g/kgBB/hari.
Gangguan metabolisme karbohidrat sangat sering terjadi pada pasien CKD. Gangguan toleransi glukosa terjadi bersamaan dengan menurunnya fungsi ginjal. Resistensi insulin dapat terdeteksi terutama ketika GFR dibawah 50 mL/min. Insulin berperan dalam aktivasi sintesis protein di otot melalui cross-signaling pathway dengan IGF-1. IGF-1 merupakan peptida kunci yang terlibat dalam pertumbuhan sel dan turnover protein, yang berperan sebagai mediator primer pada berbagai respon yang diatur oleh hormon pertumbuhan (GH) di jaringan. IGF-1 mempengaruhi aktivitas glucose-disposal, anti-apoptic dan anti-proteolitic di otot, dan memberikan beberapa cell signaling pathways dengan insulin. GH dan IGF-1 juga memiliki efek utama pada pertumbuhan ginjal, dimana struktur, fungsi dan aktivitasnya turun pada penyakit ginjal. Hal ini yang mungkin juga menyebabkan malnutrisi uremia pada CKD, akibat penurunan aktivitas GH-IGF dalam waktu lama yang mempengaruhi jaringan seperti otot. Faktor lain yang diperkirakan menyebabkan resistensi insulin pada CKD adalah inflamasi kronik, stress oksidatif, defisiensi 1.25 dihydroxy-vitamin D , hiperparatiroid sekunder, anemia dan malnutrisi. Faktor-faktor ini berkorelasi dengan meningkatnya inflammatory cytokines , adipokines, ER stress, and SOCS, menyebabkan kerusakan pada insulin receptor-signaling pathway . Gambar 5 menjelaskan resistensi insulin pada CKD.
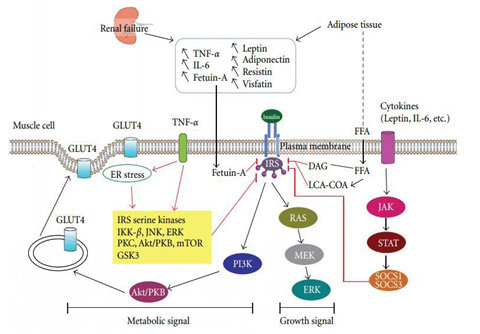
Kandungan dekstrosa dalam dialisat perlu diperhatikan karena dapat mempengaruhi metabolisme karbohidrat. Pasien CKD sering mengalami hipoglikemia saat proses dialisa, sehingga kadar dekstrosa diberikan lebih tinggi. Disisi lain, kadar dekstrosa yang tinggi pada dialisat dalat menyebabkan hiperglikemia, sehingga memperburuk resistensi insulin yang terjadi pada pasien CKD. Hipoglikemia pada pasien CKD diperkirakan akibat menurunnya glukoneogenesis dan pelepasan katekolamin, gangguan degradasi dan clearance insulin di ginjal. Untuk itu diperlukan pemantauan kadar glukosa darah berkala, khususnya saat proses dialisis.
Gangguan metabolisme lemak pada pasien CKD bervariasi tergantung derajat kerusakan ginjal, etiologi penyakit dan terapi pengganti ginjal yang dipilih. Pasien CKD dengan dialisis adalah dislipidemia dengan ciri khas hipertrigliseridemia dan kadar high density lipoprotein (HDL) rendah. Peningkatan trigliserid (TG) dapat disebabkan oleh penurunan aktivitas lipoprotein lipase (LPL) dan adanya inhibitor lipase pada CKD. Peningkatan produksi TG-rich lipoprotein seperti very low density lipoprotein (VLDL) di hati dan disfungsi degradasi TG akibat insufisien beta-oksidasi asam lemak di mitokondria menyebabkan serum TG meningkat. Hiperparatiroid sekunder, resistensi insulin, dan pemberian heparin berulang pada CKD juga diperkirakan menjadi penyebab lain peningkatan TG. Resistensi insulin pada CKD dapat memicu peningkatan VLDL yang memicu peningkatan TG. Pemberian heparin dapat menyebabkan LPL terlepas dari permukaan endotel, dimana dalam jangka panjang pasien CKD dapat mengalami deplesi LPL dan mengalami gangguan pemecahan TG.
Gangguan keseimbangan asam basa biasa dijumpai pada pasien gagal ginjal kronik/ chronic kidney failure (CKF). Asidosis metabolik merupakan problem utama pada pasien CKD, terutama ketika GFR <25% normal. Asidosis metabolik adalah meningkatnya keasaman darah secara berlebihan yang ditandai dengan rendahnya kadar bikarbonat dalam darah. Tingkat asidosis berhubungan dengan keparahan CKD dan lebih berat pada GFR yang lebih rendah. Pada insufisiensi ginjal kronis, asidosis metabolik sebagai akibat berkurangnya kemampuan ginjal dalam mereabsorbsi bikarbonat, yang merupakan prekursor utama untuk sintesis urea, untuk mengeluarkan ammonia, dan mengeluarkan ekresi asam titratable ( hyperchloremic , normal anion gap acidosis ). Pada insufisiensi ginjal yang berat, anion organik dan conjugate asam ( nonvolatile acids ) tidak dapat diekresi, dan terjadi peningkatan anion gap acidosis .
Asidosis metabolik akibat gagal ginjal kronik disebut asidosis uremia ( uremic acidosis ). Perkembangan uremic asidosis dipengaruhi banyak faktor. Produksi endogenous acid menjadi faktor penting, dimana hal ini tergantung pada diet. Konsumsi sayuran dan buah mengakibatkan produksi alkali, sehingga konsumsi jenis makanan ini dapat menunda timbulnya asidosis metabolik pada CKF. Terapi diuretik dan hipokalemia, cenderung menstimulasi produksi ammonia, kemungkinan menunda perkembangan asidosis. Pada penyakit ginjal tubulointerstitial, asidosis cenderung berkembang lebih awal daripada penyakit pada glomerular. Secara umum, gejala asidosis metabolik jarang ditemukan, jika GFR >25-20 mL/min. Asidosis menyebabkan berbagai komplikasi, seperti muscle wasting , penyakit tulang, abnormalitas pada hormon pertumbuhan dan sekresi hormon tiroid, sensitivitas insulin terganggu, dan akumulasi beta-2 microglobulin . Komplikasi lain seperti keseimbangan nitrogen negatif, anorexia, letih, gangguan fungsi sistem cardiovascular, hiperkalemia, peningkatan glukoneogenesis dan metabolisme trigliserid.
Terapi asidosis metabolik ditujukan untuk mencapai kadar bikarbonat serum mendekati normal (22-26 mmol/L). Cara terbaik dengan mengkonsumsi sodium bikarbonat secara oral (1 tablet 3x/hari) dan meningkatkan dosis jika dibutuhkan. Biasanya diberikan 650 mg sodium bikarbonat, mengandung 7.5 mmol alkali (ion HCO3- ). Biasanya pasien yang mendapat terapi sodium bikarbonat mengeluh gangguan lambung. Pada kasus ini, bisa menggunakan larutan Shohl (campuran sodium sitrat dan citric acid ). Pada pasien dengan terapi dialisis, diberikan pada dialisat.
Renal osteodystrophy , merupakan istilah yang menggambarkan abnormalitas tulang pada beberapa pasien CKD. High-turnover bone disease atau osteitis fibrosa menggambarkan manifestasi secundery hiperparatiroidism (SHPT) pada tulang. Penyebab utama gangguan mineralisasi tulang pada pasien CKD, adalah defisit vitamin D aktif ( calcitriol ) sebagaimana Gambar 2. Ginjal yang rusak tidak cukup menghidrolisis 25-hydroxycholecalciferol , yang merupakan prekursor calcitriol . Defisit calcitriol menyebabkan inadekuat absorbsi kalsium di usus halus dan mengakibatkan hipokalsemia. Retensi phospat inorganik diperkirakan dapat memperburuk kondisi ini, sebab phospat mengganggu aktivitas 1-α-hydroxylase . Hipokalsemia dan hiperphospatemia yang terjadi, menyebabkan stimulasi kelenjar paratiroid dan SHPT berikutnya, yang menyebabkan dekalsifikasi tulang. Hiperphospatemia merupakan faktor risiko cardiovascular disease (CVD) mortalily pada pasien dengan CKF, dan penyebab langsung vascular calcification pada cardio-bone connection .
Treatment defisiensi vitamin D pada pasien CKD diperlukan, mengingat beberapa terapi mungkin menurunkan atau mencegah SHPT. Pada pasien CKD dengan GFR 20-60 mL/min, defisiensi vitamin D dapat dicegah dengan suplementasi vitamin D2 ( ergocalciferol ) atau vitamin D3 ( cholecalciferol ). Recommended daily allowance (RDA) untuk usia >60 tahun adalah 800 IU dan dewasa 400 IU. Pada pasien CKD yang tergantung dialisis, dosis tinggi ergocalciferol atau 25-hydroxycholecalciferol dilaporkan dapat meningkatkan serum calcitriol . Calcitriol atau 1-α-hydroxylated vitamin D sterols seharusnya tidak diberikan untuk mengobati defisiensi vitamin D ( National Kidney Foundation, 2004).
Faktor utama penyebab anemia pada pasien CKD adalah penurunan sintesis eritropoetin di tubulus ginjal, sehingga produksi sel darah merah di sumsum tulang menurun yang disebabkan oleh penurunan fungsi parenkim ginjal. Disisi lain, radikal bebas yang ditimbulkan dari leukosit yang kontak dengan membran dialisis menyebabkan hemolisis, dengan konsekuensi anemia pada pasien CKF. Gangguan metabolik lain terkait dengan uremia yang dapat mempengaruhi produksi dan waktu paruh sel darah merah adalah toksin uremik, parathormone dan malnutrisi protein. Recombinant human erythropoietin telah dikenalkan untuk pengobatan anemia pada CKF, dan menunjukkan respon sangat bagus pada sebagian besar pasien, hanya 10% yang tidak menunjukkan respon. Penyebab utama diperkirakan karena defisiensi Fe dan berkembangnya malnutrition -inflammation complex syndrome . Eritropoetin yang kurang responsif dapat memperburuk gejala anemia dan kualitas hidup pasien, seperti intoleransi terhadap aktivitas fisik, penurunan fungsi kognitif, anorexia, insomnia dan depresi. Problem ini terkait dengan defisit L-carnitin , dimana pada pasien hemodialisis disebut sebagai dialysis -related carnitin disorder . Defisiensi L-carnitin dapat memberikan dampak negatif pada produksi eritrosit.
Oxidative stress (stres oksidatif) merupakan suatu tahapan dimana produksi reactive oxygen species (ROS) melebihi kapasitas sistem pertahanan antioxidan ( antioxidant defense system ) di dalam sel dan jaringan. ROS merupakan radikal bebas, yaitu zat kimia yang sangat reaktif dengan sebuah elektron yang tidak berpasangan di orbital bagian luar, dan bagian lain berhubungan dengn senyawa-senyawa yang reaktif (seperti hidrogen peroksida dan hypochlorous acid ) yang dapat mengikat lemak, protein dan asam nukleat dan mengubah struktur dan fungsi makromolekul tersebut. Secara spesifik, partikel LDL rusak dengan oksidasi yang berlebih, dan tidak dikenal oleh reseptor sel LDL, yang selanjutnya terakumulasi di darah dalam jumlah yang lebih tinggi dan menembus dinding vaskuler. Mekanisme ini diperkirakan yang mendasari lesi aterosklerotik. Pasien CKD dengan hemodialisis memiliki risiko mengalami stres oksidatif, dengan komplikasi klinis yang serius seperti atherosklerosis, amyloidosis , hemolysis , dan berkembangnya inflamasi kronik. Radikal-radikal bebas berasal dari leukosit, yang diaktivasi selama kontak dengan membran dialisis, juga dari Fe dalam eitrosit yang keluar akibat hemolisis. Pemberian Fe melalui intravena juga dapat menyebabkan stres oksidatif yang meningkatkan produksi radikal bebas melalui reaksi Fenton . Pemberian vitamin C dengan maksud untuk memobilisasi simpanan Fe, juga dapat menstimulasi pembentukan radikal bebas. Kemungkinan melalui berkurangnya ion Fe3+ menjadi lebih berbahaya Fe2+.
Hiperhomocysteinemia terdapat pada sebagian besar pasien CKF, dengan karakteristik konsentrasi homocysteine (Hcy) meningkat 3-4 kali di atas normal. Penyebabnya masih kurang jelas, namun kemungkinan karena kerusakan ginjal atau extrarenal metabolisme akibat toxin uremia. Pada populasi normal, hyperhomocysteinemia dianggap sebagai faktor risiko independen perkembangan CVD. Toxisitas Hcy terjadi akibat dari modifikasi struktural protien dan DNA. Kerusakan metilasi DNA terjadi akibat hyperhomocysteinemia, dan hal ini berhubungan dengan kerusakan vascular. Hcy dapat menjadi candidat utama kerusakan endotel ( endothelial dysfunction ) pada pasien CRF. Hyperhomocysteinem ia kemungkinan merusak fungsi endotel dengan menghasilkan oxigen species (radikal bebas) dan menurunkan bioavailabilitas nitric-oxide (NO). NO memediasi endotelial normal dan fungsi dinding pembuluh, seperti antitrombosis, endotelial permselectivity dan vasomotore tone . NO juga menekan proliferasi selular dan menghambat inflamasi. Endotelial NO synthase (eNOS) yang berfungsi dengan baik diperlukan untuk mengontrol bukan hanya tekanan arterial, tapi juga homeostasis glukosa dan lemak. Pada pasien CKD, terjadi gangguan fungsi eNOS-NO sistem. Namun demikian, mekanisme antara hyperhomocysteinemia dan gangguan fungsi endotel pada CRF masih belum jelas. Beberapa peneliti beranggapan bahwa akumulasi asymmetric dimethylarginine (ADMA) sebagai penyebabnya. ADMA merupakan inhibitor endogen sinthase NO. Hcy diproduksi selama sinthesis ADMA dan dapat meningkatkan katabolisme ADMA terutama dengan menghambat dimethylarginine dimthilaminohydrolase . Kadar ADMA meningkat pada pasien CKD. ADMA merupakan candidat toxin uremia yang baru. Beberapa studi melaporkan bahwa, peningkatan ADMA diindentifikasi sebagai prediktor independen kematian pada pasien CKD.